题目内容
18.姜黄素具有搞突变和预防肿瘤的作用,其合成路线如下:
已知:
①

②

请回答下列问题:
(1)D中含有的官能团名称是羧基、醛基.
(2)反应A→B的反应条件为氢氧化钠水溶液、加热;已知D→E转化中原子利用率100%,则H的结构简式为
 .
.(3)姜黄素的结构简式为
 .
.(4)D的催化氧化产物与B可以反应生成一种高分子化合物,其化学方程式为HOOC-COOH+HOCH2CH2OH$\stackrel{一定条件}{→}$
 +(2n-1)H2O.
+(2n-1)H2O.(5)下列有关E的叙述不正确的是ac(填正确答案编号).
a.1molE与浓溴水反应最多消耗3mol的Br2
b.E能发生氧化、加成、取代和缩聚反应
c.1molE最多能与3molNaOH发生反应
d. E能与FeCl3溶液发生显色反应
(6)G(C8H8O3)的同分异构体中,符合下列条件的共有6种.
①苯环上的一取代物只有2种;②1mol该物质与烧碱溶液反应,最多消耗3molNaOH.
其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为
 .
.
分析 乙烯和溴发生加成反应生成A为BrCH2CH2Br,D→E转化中原子利用率100%,由D的分子式与E的结构简式,可知D为OHC-COOH,H为 ,则B在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,B发生氧化反应生成C为OHC-CHO,E羟基被氧化生成F,F在一定条件下发生信息①中脱羧反应生成G为
,则B在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,B发生氧化反应生成C为OHC-CHO,E羟基被氧化生成F,F在一定条件下发生信息①中脱羧反应生成G为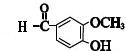 ,结合信息②及姜黄素的分子式,可知姜黄素的结构简式为:
,结合信息②及姜黄素的分子式,可知姜黄素的结构简式为: ,据此解答.
,据此解答.
解答 解:乙烯和溴发生加成反应生成A为BrCH2CH2Br,D→E转化中原子利用率100%,由D的分子式与E的结构简式,可知D为OHC-COOH,H为 ,则B在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,B发生氧化反应生成C为OHC-CHO,E羟基被氧化生成F,F在一定条件下发生信息①中脱羧反应生成G为
,则B在氢氧化钠水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,B发生氧化反应生成C为OHC-CHO,E羟基被氧化生成F,F在一定条件下发生信息①中脱羧反应生成G为 ,结合信息②及姜黄素的分子式,可知姜黄素的结构简式为:
,结合信息②及姜黄素的分子式,可知姜黄素的结构简式为: .
.
(1)D为OHC-COOH,含有的官能团名称是羧基、醛基,故答案为:羧基、醛基;
(2)反应A→B发生卤代烃的水解反应,反应条件为:氢氧化钠水溶液、加热;已知D→E转化中原子利用率100%,则H的结构简式为: ,
,
故答案为:氢氧化钠水溶液、加热; ;
;
(3)姜黄素的结构简式为: ,
,
故答案为: ;
;
(4)D为OHC-COOH,催化氧化产物为HOOC-COOH,与B可以反应生成一种高分子化合物,其化学方程式为:HOOC-COOH+HOCH2CH2OH$\stackrel{一定条件}{→}$ +(2n-1)H2O,
+(2n-1)H2O,
故答案为:HOOC-COOH+HOCH2CH2OH$\stackrel{一定条件}{→}$ +(2n-1)H2O;
+(2n-1)H2O;
(5)a.E中酚羟基邻位有H原子,1molE与浓溴水反应最多消耗1mol的Br2,故a错误;
b.E中含有羧基、羟基,能发生氧化、取代和缩聚反应,含有苯环,能与氢气发生加成反应,故b正确;
c.羧基、酚羟基能与氢氧化钠反应,1molE最多能与2molNaOH发生反应,故c错误;
d. E含有酚羟基,能与FeCl3溶液发生显色反应,故d正确,
故选:ac;
(6)G( )的同分异构体中,符合下列条件:①苯环上的一取代物只有2种,②1mol该物质与烧碱溶液反应,最多消耗3molNaOH,可以是-OH、-OOCHCH3处于对位,可以含有3个-OH、1个-CH=CH2,3个-OH相邻时,-CH=CH2有2种位置,苯环的一氯代物只有2种,3个-OH为偏位时,-CH=CH2有3种位置,苯环的一氯代物只有2种,3个-OH为均位时,-CH=CH2有1种位置,此时苯环的一氯代物只有1种,故符合条件的同分异构体有6种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为
)的同分异构体中,符合下列条件:①苯环上的一取代物只有2种,②1mol该物质与烧碱溶液反应,最多消耗3molNaOH,可以是-OH、-OOCHCH3处于对位,可以含有3个-OH、1个-CH=CH2,3个-OH相邻时,-CH=CH2有2种位置,苯环的一氯代物只有2种,3个-OH为偏位时,-CH=CH2有3种位置,苯环的一氯代物只有2种,3个-OH为均位时,-CH=CH2有1种位置,此时苯环的一氯代物只有1种,故符合条件的同分异构体有6种,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为  ,
,
故答案为:6; .
.
点评 本题考查有机物的推断与合成,需要学生对给予的信息进行利用,综合考查学生自学能力与分析推理能力,注意掌握官能团想性质与转化,(6)中同分异构体书写为易错点,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 28g氮气所含有的原子数目为NA | |
| B. | 化学反应中1mol金属镁变成镁离子时得到电子数目为2NA | |
| C. | 有一种黄绿色气体,用湿润的淀粉KI试纸检测时,变蓝说明是氯气 | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |
| A. | 绿色食品就是不含任何化学物质的食品 | |
| B. | 燃煤时添加生石灰以减少SO2的排放 | |
| C. | PM2.5是指环境空气中直径小于或等于2.5微米的颗粒物 | |
| D. | pH在5.6~7.0之间的降水通常称为酸雨 |
| 选项 | A | B | C | D |
| 实验 操作 | 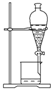 | 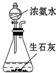 | 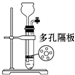 | 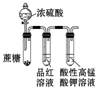 |
| 实验 目的 | 分离乙酸与乙酸乙酯的混合液 | 制取氨气 | 盐酸与碳酸钙反应,验证碳与氯的非金属性强弱 | 验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和NO2(g)的生成速率相同 | D. | SO3(g)和NO(g)的浓度比为1:1 |
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.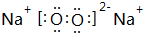 ,CB2的电子式 为
,CB2的电子式 为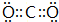 .
.
 )具有高度的对称性,Eaton教授在此基础上经七步反应合成了二羧基立方烷,二羧基立方烷的同分异构体数目为( )
)具有高度的对称性,Eaton教授在此基础上经七步反应合成了二羧基立方烷,二羧基立方烷的同分异构体数目为( )


 .
.