题目内容
20.下表物质与其所含化学键类型、所属化合物类型不正确的一组是( )| 选 项 | A | B | C | D |
| 物 质 | Na2O2 | H2O | HCl | NaCl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 离子化合物 |
| A. | A | B. | B | C. | C | D. | D |
分析 一般来说,活泼金属和活泼金属元素之间易形成离子键,非金属元素之间易形成共价键,共价化合物中只含共价键,离子化合物中一定含有离子键,可能含有共价键,据此分析解答.
解答 解:A.Na2O2中含共价键和离子键是离子化合物,故A正确;
B.H2O中只含共价键,属于共价化合物,故B正确;
C.HCl中只含共价键,氢原子和氯原子之间存在共价键,属于共价化合物,故C错误;
D.NaCl中钠离子和氯离子之间存在离子键,属于离子化合物,故D正确;
故选:C.
点评 本题考查化学键、化合物的类型,明确元素之间的成键原因、化学键与化合物的关系是解答本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.将浓盐酸滴入KMnO4溶液,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+.据此判断下列说法正确的是( )
| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.8 NA | |
| D. | 此实验条件下,物质的氧化性:NaBiO3>KMnO4>Cl2 |
11.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol-OH中含有10 NA个电子 | |
| B. | 1 L 1 mol•L-1CH3COONa溶液中含有NA个CH3COO- | |
| C. | 28g晶体硅中含有共价键数目为2NA个 | |
| D. | 常温常压下11.2 L甲烷气体含有的分子数为0.5NA |
8.下列说法中正确的是( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 化学反应中1mol金属镁变成镁离子时得到电子数目为2NA | |
| C. | 有一种黄绿色气体,用湿润的淀粉KI试纸检测时,变蓝说明是氯气 | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |
15.下列物质在所述变化中,既发生离子键破坏,又发生共价键破坏的是( )
| A. | 干冰升华 | B. | 烧碱融化 | C. | HCl气体溶于水 | D. | NH4Cl受热分解 |
5.下列有关电解质的说法不正确的是( )
| A. | K+、Mg2+、I-、NO3-在无色溶液中能大量共存 | |
| B. | K+、Na+、CO32-、NO3-在酸性溶液中不能大量共存 | |
| C. | CO2与少量烧碱溶液反应:CO2+2OH-=CO32-+H2O | |
| D. | 向AlCl3溶液中加入过量的氨水溶液Al3++3NH3.H2O=Al(OH)3↓+3NH4+ |
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.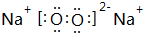 ,CB2的电子式 为
,CB2的电子式 为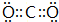 .
. )具有高度的对称性,Eaton教授在此基础上经七步反应合成了二羧基立方烷,二羧基立方烷的同分异构体数目为( )
)具有高度的对称性,Eaton教授在此基础上经七步反应合成了二羧基立方烷,二羧基立方烷的同分异构体数目为( )