题目内容
(1)下表列出了a-f六种元素在周期表前三周期的位置.
请回答下列问题:
①c元素的名称是 ,d元素位于 族.
②六种元素中, 元素的性质最稳定, 元素的原子半径最大.(填元素符号)
③非金属性b c.(填“大于”“小于”)
④六种元素中,最高价氧化物属于两性氧化物的是 ,最高价氧化物对应水化物酸性最强的是 .(填化学式)
(2)①下表是几种烷烃的物理性质
通过阅读,我们发现烷烃的物理性质呈现一些规律性的变化,如:烷烃随着分子中碳原子数的递增,沸点逐渐 ;相对密度逐渐 .
②烷烃的同分异构体数目随碳原子数的增加而增加,丁烷有 种同分异构体,其结构简式分别是 、 .
③乙烯是最简单的烯烃,能使溴水褪色,该反应的化学方程式是: .
| a | |||||||
| b | c | ||||||
| d | e | f | |||||
①c元素的名称是
②六种元素中,
③非金属性b
④六种元素中,最高价氧化物属于两性氧化物的是
(2)①下表是几种烷烃的物理性质
| 名称 | 常温时的状态 | 结构简式 | 熔点/.C | 沸点/.C | 相对密度 |
| 甲烷 | 气 | CH4 | -l82.5 | -161.5 | |
| 乙烷 | 气 | CH3CH3 | -l82.8 | -88.6 | |
| 丙烷 | 气 | CH3CH2CH3 | -188.0 | -42.1 | 0.5005 |
| 戊烷 | 液 | CH3(CH2)3CH3 | -129.7 | 36.0 | 0.5572 |
| 癸烷 | 液 | CH3(CH2)3CH3 | -29.7 | 172.1 | 0.7298 |
| 十七烷 | 固 | CH3(CH2)15CH3 | 22 | 302.2 | 0.7767 |
②烷烃的同分异构体数目随碳原子数的增加而增加,丁烷有
③乙烯是最简单的烯烃,能使溴水褪色,该反应的化学方程式是:
考点:位置结构性质的相互关系应用,烷烃及其命名
专题:元素周期律与元素周期表专题,有机物分子组成通式的应用规律
分析:(1)由元素在周期表中的位置可知a为He,b为N,c为O,d为Na,e为Al,f为Cl,结合元素周期律知识可解答该题;
(2)①由表中数据可知,烷烃的相对分子质量越大,烷烃的密度越大,沸点越高;
②丁烷有2种同分异构体,分别为正丁烷和异丁烷;
③乙烯与溴发生加成反应生成1,2-二溴乙烷.
(2)①由表中数据可知,烷烃的相对分子质量越大,烷烃的密度越大,沸点越高;
②丁烷有2种同分异构体,分别为正丁烷和异丁烷;
③乙烯与溴发生加成反应生成1,2-二溴乙烷.
解答:
解:(1)由元素在周期表中的位置可知a为He,b为N,c为O,d为Na,e为Al,f为Cl,
①由以上分析可知c为氧元素,d为Na元素,位于周期表第三周期第IA族,故答案为:氧;IA;
②六种元素中,He为惰性气体元素,性质最稳定,Na元素的原子半径最大,故答案为:He;Na;
③同周期元素从左到右,元素的非金属性逐渐增大,则b非金属性小于c,故答案为:小于;
④最高价氧化物属于两性氧化物的是Al2O3,最高价氧化物对应水化物酸性最强的HClO4,故答案为:Al2O3;HClO4;
(2)①根据表中数据知,烷烃的碳原子个数越大,烷烃的沸点逐渐升高、密度都逐渐增大,故答案为:升高;增大;
②丁烷有正丁烷和异丁烷,其结构简式分别为:CH3CH2CH2CH3、(CH3)3CH,故答案为:两;CH3CH2CH2CH3、(CH3)3CH;
③乙烯和溴发生加成反应生成1,2-二溴乙烷,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br.
①由以上分析可知c为氧元素,d为Na元素,位于周期表第三周期第IA族,故答案为:氧;IA;
②六种元素中,He为惰性气体元素,性质最稳定,Na元素的原子半径最大,故答案为:He;Na;
③同周期元素从左到右,元素的非金属性逐渐增大,则b非金属性小于c,故答案为:小于;
④最高价氧化物属于两性氧化物的是Al2O3,最高价氧化物对应水化物酸性最强的HClO4,故答案为:Al2O3;HClO4;
(2)①根据表中数据知,烷烃的碳原子个数越大,烷烃的沸点逐渐升高、密度都逐渐增大,故答案为:升高;增大;
②丁烷有正丁烷和异丁烷,其结构简式分别为:CH3CH2CH2CH3、(CH3)3CH,故答案为:两;CH3CH2CH2CH3、(CH3)3CH;
③乙烯和溴发生加成反应生成1,2-二溴乙烷,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br.
点评:本题考查了元素周期表及元素周期律的综合应用、同分异构体现象、乙烯的性质等知识点,根据物质的性质及元素周期律、烷烃和烯烃的性质来分析,熟悉元素周期律并灵活运用元素周期律来解答,题目难度不大.

练习册系列答案
相关题目
下列叙述中错误的是( )
| A、元素的性质呈周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 |
| B、主族元素在周期表中的位置取决于该元素原子的电子层数和最外层电子数 |
| C、除零族元素外,短周期元素的最高正化合价在数值上都等于该元素所属的族序数 |
| D、副族元素中没有非金属元素 |
下列除杂质的选择,(括号中是除杂试剂)不正确的是( )
| A、KHCO3溶液中混有K2CO3(CO2) |
| B、NaOH固体中混有Na2O2(H2O) |
| C、Na2CO3溶液中混有NaHCO3(CaCl2) |
| D、KNO3固体中混有KHCO3(HNO3) |
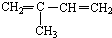 与Br2按物质的量之比1:1发生1,4加成反应方程式
与Br2按物质的量之比1:1发生1,4加成反应方程式