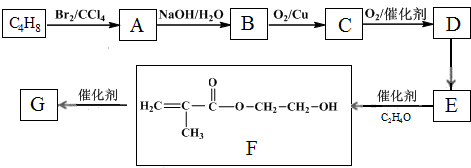
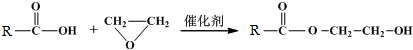
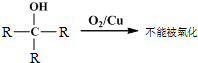
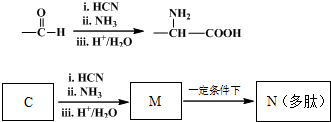
题目内容
将6mol A气体和5mol B气体混合放入4L密闭容器中,发生下列反应:
3A(g)+B(g)?2C(g)+xD(g),经过5min达到化学平衡,此时生成C为2mol,测得D的反应速率为0.1mol/L?min,计算:
①x的值;
②平衡时B的转化率;
③A的平衡浓度;
④求平衡常数K.(精确到小数点后两位)
3A(g)+B(g)?2C(g)+xD(g),经过5min达到化学平衡,此时生成C为2mol,测得D的反应速率为0.1mol/L?min,计算:
①x的值;
②平衡时B的转化率;
③A的平衡浓度;
④求平衡常数K.(精确到小数点后两位)
考点:化学平衡的计算
专题:化学平衡专题
分析:根据三段式计算出各组分物质的量变化量、平衡时物质的量,
①利用化学计量数之比等于物质的量之比计算x;
②B的转化率=
×100%;
③根据c=
计算;
④依据化学方程式计算平衡浓度,结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到.
①利用化学计量数之比等于物质的量之比计算x;
②B的转化率=
| 消耗量 |
| 起始量 |
③根据c=
| n |
| V |
④依据化学方程式计算平衡浓度,结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到.
解答:
解:平衡时生成C为2mol,D的平均反应速率为0.1mol/(L?min),生成D的物质的量为0.1mol/(L?min)×5min×4L=2mol,则:
3A(g)+B(g)?2C(g)+xD(g)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2
①物质的量之比等于化学计量数之比,故2:2=1:x,则x=2,答:计算可知x为2;
②B的转化率为=
×100%=20%,答:平衡时B的转化率为20%;
③平衡时A的浓度=
=0.75mol/L,答:A的平衡浓度为0.75mol/L;
④反应平衡常数K=
=0.15,答:反应平衡后平衡常数为015.
3A(g)+B(g)?2C(g)+xD(g)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2
①物质的量之比等于化学计量数之比,故2:2=1:x,则x=2,答:计算可知x为2;
②B的转化率为=
| 1mol |
| 5mol |
③平衡时A的浓度=
| 3mol |
| 4L |
④反应平衡常数K=
(
| ||||
(
|
点评:本题考查了化学平衡的计算,主要是平衡浓度、平衡转化率、平衡常数的计算应用,注意对速率公式的理解与灵活运用,注意三段式应用,难度不大.

练习册系列答案
相关题目
下列物质的水溶液能导电,但其本身属于非电解质的是( )
| A、C2H5OH |
| B、CO2 |
| C、Cl2 |
| D、BaSO4 |
下列各图所表示的反应是吸热反应的是( )
A、 反应过程 |
B、 反应过程 |
C、 反应过程 |
D、 反应过程 |
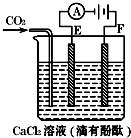 如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2持续通入电解液中.
如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2持续通入电解液中.