题目内容
14.几种短周期元素的原子半径及主要化合价如表:下列叙述不正确的是( )| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.075 | 0.074 |
| 主要化合价 | +2 | +3 | +5,+3,-3 | -2 |
| A. | X.Y元素的金属性X>Y | B. | Z,W元素的非金属性Z>W | ||
| C. | Y,W形成的化合物具有两性 | D. | Z的氢化物为一种碱性气体 |
分析 W化合价为-2价,没有最高正化合价+6价,故W为氧元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为氮元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为镁元素,Y为铝元素.结合元素周期律知识解答该题.
解答 解:A.同周期自左而右,金属性减弱,所以X、Y元素的金属性X>Y,故A正确;
B.Z为N元素,W为O元素,则元素的非金属性Z<W,故B错误;
C.Y为铝元素,W为O元素,二者形成的化合物为氧化铝,为两性氧化物,故C正确;
D.Z为N元素,对应的氢化物氨气为碱性气体,故D正确.
故选B.
点评 本题考查元素位置结构和性质的关系及应用,为高频考点,侧重考查学生的分析能力,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列物质在生活中应用时,起还原作用的是( )
| A. | 明矾作净水剂 | B. | 硅胶做干燥剂 | ||
| C. | 漂粉精作消毒剂 | D. | 铁粉作食品袋内的脱氧剂 |
9.常温下,用0.10mol•L-1的HCl溶液滴定20.00mol•L-1氨水,滴定曲线如图.下列说法正确的是( )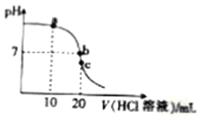

| A. | a点对应的溶液中,c(Cl-)>c(NH4+ )>c(OH- )>c(H+ ) | |
| B. | b点对应的溶液中,c(NH4+)>c(Cl-),c(OH- )=c(H+ ) | |
| C. | c点对应的溶液中,c(H+)=c(NH3•H2O)+c(OH- ) | |
| D. | 滴定过程中可能出现:c(NH4+ )>c(OH- )>c(H+ )>c(Cl-) |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L lmol•L-1 FeBr2溶液与l molCl2反应时转移的电子数目为3NA | |
| B. | 7g分子式为CnH2n的链烃中含有的C-H键的数目为NA | |
| C. | 常温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 0.5mol•L-1硫酸钠溶液中含有溶质离子总数为1.5NA |
6.CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色.向反应后溶液中通入过量SO2,溶液变成无色.下列说法正确的是( )
| A. | 滴加KI溶液时,CuI是还原产物,KI被还原 | |
| B. | 通入SO2后,溶液变无色,体现SO2的漂白性 | |
| C. | 整个过程发生了复分解反应和氧化还原反应 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
3.下列说法正确的是( )
| A. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Ksp均增大 | |
| C. | 25℃时pH=11的NaOH,当温度升高到80℃时,其pH不变 | |
| D. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明CH3COOH 是弱电解质 |
4.在自然界中只能以化合态存在的元素是( )
| A. | 氮 | B. | 氯 | C. | 硫 | D. | 碳 |
 .
.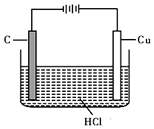 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.