题目内容
2.已知A为常见的金属单质,根据如图所示的转化关系回答下列问题: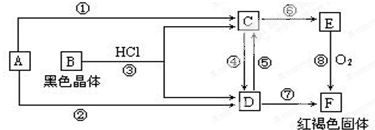
(1)写出B的化学式:Fe3O4;
(2)写出 ⑤的离子方程式:2Fe3++Fe=3Fe2+;
(3)写出⑧的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 已知A为常见的金属单质,由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,A为Fe,B为黑色晶体,能够与盐酸反应生成C、D,结合E、F可知C为FeCl2,D为FeCl3,然后结合物质的性质及常见化学用语的表示方法进行解答.
解答 解:A为常见的金属单质,由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,A为Fe,B为黑色晶体,能够与盐酸反应生成C、D,结合E、F可知C为FeCl2,D为FeCl3,
(1)根据分析可知,黑色晶体B应为四氧化三铁,化学式为:Fe3O4,
故答案为:Fe3O4;
(2)反应⑤为FeCl3与Fe反应生成FeCl2,反应的离子方程式为:2Fe3++Fe═3Fe2+,
故答案为:2Fe3++Fe=3 Fe2+;
(3)反应⑧E→F为Fe(OH)2与氧气反应,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:4 Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物的推断,题目难度不大,红褐色固体F为解答本题的突破口,注意常见元素及其化合物性质,明确铁及其化合物性质,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
3.可逆反应在一定条件下达到化学平衡时,下列说法不正确的是( )
| A. | 正反应速率等于逆反应速率 | B. | 各组分浓度不再发生变化 | ||
| C. | 反应体系中某组分的组成保持不变 | D. | 正、逆反应速率都为零 |
7.下列实验操作正确的是( )
| A. | 用pH试纸测定新制氯水的pH=2 | |
| B. | 用玻璃棒在过滤器上搅拌以加速硫酸铜晶体的洗涤 | |
| C. | 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则该溶液中不一定含有SO${\;}_{4}^{2-}$ | |
| D. | 向可溶性淀粉溶液中滴加碘酒,溶液呈蓝色,用CCl4作萃取剂振荡、静置后,下层呈紫红色 |
7.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法中正确的是( )
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
14.室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )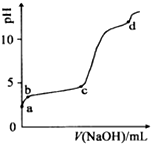

| A. | a点溶液呈酸性的原因是Al3+水解,离子方程为:Al3++3OH-?Al(OH)3 | |
| B. | c点铝元素主要以Al(OH)3的形式存在 | |
| C. | a-b段,溶液pH增大,Al3+浓度不变 | |
| D. | d点Al(OH)3沉淀开始溶解 |

 侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)
侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)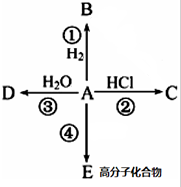 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下课发生如图所示的转化,请回答下列问题.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下课发生如图所示的转化,请回答下列问题. ,D中所含的官能团为羟基.
,D中所含的官能团为羟基.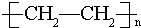 ,反应类型为加聚反应.
,反应类型为加聚反应.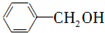
 c.
c.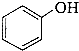
 )常被用来制作一次性泡沫饭盒的材料聚苯乙烯.
)常被用来制作一次性泡沫饭盒的材料聚苯乙烯. .
. .
. 的流程如下(部分条件省略)
的流程如下(部分条件省略)
 .
. .
. .
.