题目内容
NA为阿伏加德罗常数,下列说法正确的是( )
| A、22.4L水蒸气中含有NA个H2O分子 |
| B、16g 氧气和16g 臭氧含有的电子总数均为8NA |
| C、1 mol乙炔分子中含3NA个碳碳叁键 |
| D、2.3g金属钠与乙醇反应时失去的电子数是0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、没有告诉在标准状况下,且标况下水的状态不是气体,题中条件无法计算22.4L水的物质的量;
B、16g臭氧和氧气中都含有16g氧原子,1mol氧原子中含有8mol电子;
C、乙炔分子中含有一个碳碳三键,1mol乙炔中含有1mol碳碳三键;
D、2.3g钠的物质的量为0.1mol,钠为1价金属,0.1mol钠完全反应失去0.1mol电子.
B、16g臭氧和氧气中都含有16g氧原子,1mol氧原子中含有8mol电子;
C、乙炔分子中含有一个碳碳三键,1mol乙炔中含有1mol碳碳三键;
D、2.3g钠的物质的量为0.1mol,钠为1价金属,0.1mol钠完全反应失去0.1mol电子.
解答:
解:A、不是标况下,标况下水不是气体,没有使用标况下的气体摩尔体积计算水的物质的量,故A错误;
B、16g氧气和16g臭氧中都含有16g氧原子,16g氧原子的物质的量为1mol,含有8mol电子,所以二者都含有8mol电子,含有的电子总数均为8NA,故B正确;
C、1mol乙炔中含有1mol碳碳三键,含NA个碳碳叁键,故C错误;
D、2.3g钠的物质的量为0.1mol,0.1mol钠完全反应失去0.1mol电子,失去的电子数是0.1NA,故D正确;
故选BD.
B、16g氧气和16g臭氧中都含有16g氧原子,16g氧原子的物质的量为1mol,含有8mol电子,所以二者都含有8mol电子,含有的电子总数均为8NA,故B正确;
C、1mol乙炔中含有1mol碳碳三键,含NA个碳碳叁键,故C错误;
D、2.3g钠的物质的量为0.1mol,0.1mol钠完全反应失去0.1mol电子,失去的电子数是0.1NA,故D正确;
故选BD.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、2.4g Mg与足量的二氧化碳完全反应失去的电子数为0.2NA |
| B、22.4 L氯气与过量的铁完全反应,转移电子数为2NA |
| C、含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2:3 |
| D、1.8g 1H218O中含有的中子数为NA |
氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20.某硫酸铜溶液中c(Cu2+)=0.02mol/L,若要生成Cu(OH)2沉淀,应调整溶液pH使之大于( )
| A、3 | B、5 | C、7 | D、9 |
 关于反应3H2(g)+N2(g)?2NH3(g)发生过程中的能量变化如图,
关于反应3H2(g)+N2(g)?2NH3(g)发生过程中的能量变化如图,下列说法中不正确的是( )
| A、该反应为放热反应 |
| B、反应体系中加入催化剂,E1、E2减小,△H不变 |
| C、增大反应体系压强,反应速率增大,化学平衡常数增大 |
| D、降低反应体系温度,反应速率减慢,H2的转化率增大 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、某二元弱酸的酸式盐NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| C、NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)=c(NH4+)>c(OH-)=c(H+) |
| D、常温下,将50mL0.1 mol?L-1的盐酸与100mL0.1 mol?L-1的氨水混合,所得溶液中:c(NH4+)>c(Cl-)>c(NH3?H2O)>c(OH-)>c(H+) |
下列实验操作符合要求的是( )
A、 定容 |
B、 收集氨水 |
C、 高温煅烧石灰石 |
D、 除去氯水中的氯化氢 |

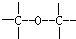 ④
④
