题目内容
2. 磷元素是生命体中重要的元素之一
磷元素是生命体中重要的元素之一(1)磷是某种核素中,中子数比质子数多一,则该核素的原子符号为3115P.
(2)磷化氢气体制取原理类似于实验室制取氨气,在加热的条件下用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式为PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O.
(3)实验室用硫酸铜溶液吸收PH3的化学方程式为24CuSO4+11PH3+12H2O=8Cu3P↓+3H2PO4+24H2SO4,其中还原剂PH3,当生成196克H2SO4时,转移电子2mol.
(4)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1:1:1,写出相应的化学方程式:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑.
(5)氧硫化碳水解及部分应用流程如图所示(部分产物已略去)COS$→_{Ⅰ}^{H_{2}O}$H2S$→_{Ⅱ}^{NaOH溶液}$Na2S溶液$→_{Ⅲ}^{△}$M溶液+H2
①组成氧硫化碳的各原子中,原子半径最大的元素在周期表中的物质是第三周期第ⅥA族.
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-.
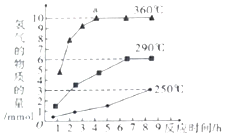
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol).由图象分析可知,a点时M溶液中除S2O32-外,还有SO42-(填含硫微粒的离子符号)
分析 (1)磷是某种核素中,中子数比质子数多一,所以中子数为16,所以质量数为31;
(2)N与P处在同一主族,根据碘化氨合碱的反应书写反应方程式;
(3)该方程式中Cu价态由+2→+1,所以氧化剂是硫酸铜,还原剂是PH3;24molH2SO4转移电子为24mol;
(4)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐分别是硫酸氢钾和硫酸氢铵,且物质的量之比为1:1:1,根据原子守恒分析解答;
(5)①氧硫化碳(COS)中硫三个电子层,其它两个是两个电子层,所以硫原子半径最大;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,依据电荷守恒和原子守恒书写离子反应方程式;
③根据图示反应时间与H2产量的关系,a点时M溶液中除S2O32-外,还有SO42-.
解答 解:(1)磷是某种核素中,中子数比质子数多一,所以中子数为16,所以质量数为31,所以该核素的原子符号为3115P,故答案为:3115P;
(2)铵盐和碱反应生成氨气,N与P处在同一主族,磷盐和碱反应生成磷化氢,反应为:PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O,
故答案为:PH4I+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$PH3↑+NaI+H2O;
(3)该方程式中Cu价态由+2→+1,所以氧化剂是硫酸铜,还原剂是PH3,24molH2SO4转移电子为24mol,所以196克H2SO4时,转移电子的物质的量为2mol,故答案为:PH3;2;
(4)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐分别是硫酸氢钾和硫酸氢铵,且物质的量之比为1:1:1,反应方程式为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑,
故答案为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑;
(5)①氧硫化碳(COS)中硫三个电子层,其它两个是两个电子层,所以硫原子半径最大,硫在周期表中的位置为第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,
故答案为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-;
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,生成氢气:3mmol×2=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,离子反应为S2-+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+4H2↑,
故答案为:SO42-.
点评 本题考查学生氧化还原反应的方程式的书写以及电子转移的计算知识,属于综合知识的考查,侧重分析与应用能力的考查,注意含硫物质的性质及规律性知识的应用,题目难度不大.

【实验I】SO2与漂粉精反应.
| 操作 | 现象 |
| 取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?不合理请说明理由因为白雾中可能含有少量Cl2和SO2,也容易产生沉淀.
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.该反应的离子方程式为ClO-+Cl-+2H+=2H2O+Cl2↑.
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是CaSO4(填化学式);
②用离子方程式解释现象3中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
【实验II】SO2与过氧化钠反应.将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好.在室温下按图示装置进行实验,请填写空白.

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)淡黄色固体变为白色粉末 | (2)反应的化学方程式:SO2+Na2O2=Na2SO4 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)Z中NaOH溶液倒吸入Y管中 | (4)不用解释 |
| A. | 含有0.2mol K2SO4 | |
| B. | K+的物质的量浓度为0.2mol•L-1 | |
| C. | K的物质的量为0.8mol | |
| D. | 取出1LK2SO4溶液后,剩余K2SO4溶液的浓度变为0.1mol•L-1 |
| A. |  实验室用大理石和盐酸制备二氧化碳 | |
| B. |  制取SO2、检验SO2的漂白性 | |
| C. |  提纯氢氧化铁胶体 | |
| D. |  实验室用乙醇和浓硫酸制乙烯 |
| A. | KMnO4→MnO2 | B. | HCl→Cl2 | C. | Fe2O3→Fe | D. | CaO→CaCO3 |
①苯不能使酸性KMnO4溶液褪色
②苯中6个碳碳键完全相同
③苯能在一定条件下与氢气加成生成环己烷
④实验室测得二甲苯只有三种结构
⑤苯分子具有平面正六边形结构( )
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+ )=c(OH- )+c(A- ) | |
| B. | 25℃时,pH=4.7浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 氢硫酸的酸性比碳酸弱,则NaHS溶液中:c(Na+)>c(HS-)>c(H+)>c(OH-) | |
| D. | ①0.2mol•L-1NH4Cl溶液②0.1mol•L-1(NH4)2Fe(SO4)2溶液③0.2mol•L-1NH4HSO4溶液④0.1mol•L-1(NH4)2CO3溶液中,c(NH4+ )大小:③>②>①>④ |