题目内容
3.下列物质中,既有离子键又有共价键的是( )| A. | MgCl2 | B. | NH4Cl | C. | CO2 | D. | H2S |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析.
解答 解:A.氯化镁中只含离子键,故A错误;
B.NH4Cl中铵根离子与氯离子之间为离子键,N原子与H原子之间为共价键,故B正确;
C.二氧化碳中只存在C=O共价键,故C错误;
D.硫化氢中只含共价键,故D错误;
故选B.
点评 本题考查了化学键的判断,根据物质的构成微粒及微粒间的作用力来分析解答,注意离子键和共价键的区别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列相关反应的离子方程式书写正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO22ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
14.若苯的环上三个氢原子分别被-Cl、-Br、-I取代,能生成的同分异构体数目是( )
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
11.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )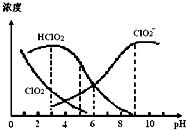

| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 该温度下HClO2的电离平衡常数的数值Ka≈1.0×10-6 | |
| D. | 不同pH的NaClO2溶液中存在下列关系:c( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) |
8.下列各组元素的原子序数中,其相应的元素原子能形成X2Y共价化合物的是( )
| A. | 11与16 | B. | 1与8 | C. | 12与17 | D. | 6与8 |
12.下列化合物中与自身类别相同的同分异构体数目(不考虑立体异构)最多的是( )
| A. | 戊烷 | B. | 戊烯 | C. | 乙酸乙酯 | D. | 丁醇 |
13.下列分子中,所有原子都满足最外层为8电子结构的是( )
| A. | BF3 | B. | PCl5 | C. | NCl3 | D. | CH4 |
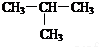

 ,(2)NH3:
,(2)NH3: ,
,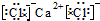 ,(4)CO2:
,(4)CO2: .
.