题目内容
9.有下列七种物质:①甲烷、②苯、③聚乙烯、④聚乙炔、⑤2-丁炔、⑥环己烷、⑦环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )| A. | ②③④⑤ | B. | ③④⑤⑦ | C. | ④⑤⑥ | D. | ④⑤⑦ |
分析 既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的有机物,应含有不饱和碳碳键或醛基,以此解答该题.
解答 解:①甲烷为饱和烃,与酸性高锰酸钾或溴水都不反应,故①错误;
②苯结构特殊、性质稳定,与酸性高锰酸钾或溴水都不反应,故②错误;
③聚乙烯不含不饱和键,不能与酸性高锰酸钾或溴水反应,故③错误;
④聚乙炔含有碳碳双键,可与酸性高锰酸钾或溴水反应,故④正确;
⑤2-丁炔含有碳碳三键,可与酸性高锰酸钾或溴水反应,故⑤正确;
⑥环己烷不含不饱和键,不能与酸性高锰酸钾或溴水反应,故⑥错误;
⑦环己烯含有碳碳双键,可与酸性高锰酸钾或溴水反应,故⑦正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,注意常见有机物官能团的性质,把握与酸性高锰酸钾或溴水反应的物质.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
20.运用相关化学知识进行判断,下列结论错误的是( )
| A. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 某吸热反应能自发进行,因此该反应是熵增反应 |
17.下列离子方程式书写正确的是( )
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠和水的反应:Na+2H2O=H2↑+Na++2OH- | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+=Al3++3H2O | |
| D. | Ba(OH)2溶液中加入稀H2SO4:Ba2++SO42-=BaSO4↓ |
14. 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”); 常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-═Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
将X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+).
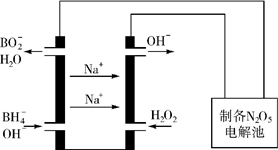
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”); 常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是AD
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-═Ca3(PO4)2↓+2H+(用离子方程式表示).
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图.则硼氢化钠燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
1.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW2 |
15.质量数为37的原子,应该有( )
| A. | 18个质子,19中子,19电子 | B. | 18个质子,20个中子,18个电子 | ||
| C. | 19个质子,18个中子,20个电子 | D. | 18个质子,19个中子,18个电子 |