题目内容
1.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW2 |
分析 W化合价为-2价,没有最高正化合价+6价,故W为O元素;
Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,故Z为N元素;
X化合价为+2价,应为ⅡA族元素,Y的化合价为+3价,处于ⅢA族,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素,结合元素周期律与元素化合物性质解答
解答 解:W化合价为-2价,没有最高正化合价+6价,故W为O元素;
Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,故Z为N元素;
X化合价为+2价,应为ⅡA族元素,Y的化合价为+3价,处于ⅢA族,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素,
A.同周期随原子序数增大金属性减弱,故金属性X(Mg)>Y(Al),故A错误;
B.一定条件下,氧气与氨气反应生成氮气与水,置换出氮气,故B正确;
C.Y的最高价氧化物对应的水化物为氢氧化铝,溶于强酸、强碱,不能溶于稀氨水,故C错误;
D.一定条件下,氮气与氧气反应生成NO,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,难度中等,根据元素的化合价与半径推断元素是解题的关键,注意元素周期律的理解掌握.

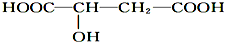 下列相关说法正确的是( )
下列相关说法正确的是( )| A. | 苹果酸在一定条件下能催化氧化生成醛 | |
| B. | 苹果酸在一定条件下能发生取代和消去反应 | |
| C. | 苹果酸在一定条件下能发生加聚反应生成高分子化合物 | |
| D. | 1 mol苹果酸与Na2CO3溶液反应最多消耗1 mol Na2CO3 |
| A. | ②③④⑤ | B. | ③④⑤⑦ | C. | ④⑤⑥ | D. | ④⑤⑦ |
| A. | 离子半径C>D>B>A | B. | 原子序数D>C>B>A | ||
| C. | 原子半径A>B>D>C | D. | 单质的还原性A>B>D>C |
一定条件下,通过下列反应可以制备特种陶瓷的原料M gO: MgSO4(s)+ CO(g)  MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
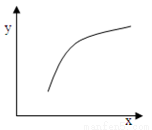
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
| A. | 天然气的主要成份是乙烯,芳香烃主要来自于煤的干馏后的煤焦油 | |
| B. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是德国化学家李比希 | |
| C. | 汽油、煤油、柴油主要来自于石油的常压蒸馏和石油的催化裂化 | |
| D. | 乙烷、丙烷中的化学键既有极性键又有非极性键 |
| A. | 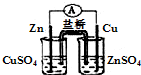 构成锌-铜原电池 | B. |  碘的CCl4溶液中分离I2并回收CCl4 | ||
| C. | 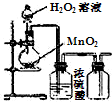 制取O2 | D. | 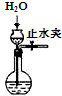 检查装置气密性 |
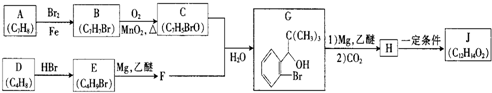
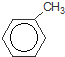 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$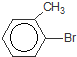 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应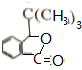
 .
.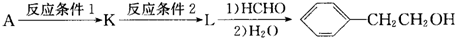
 .
.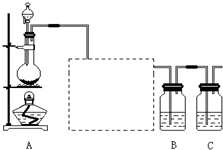 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: