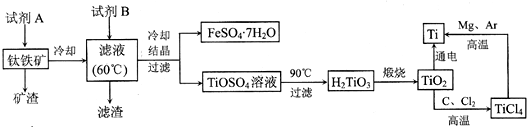
题目内容
一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)?CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示,下列叙述真确的是( )
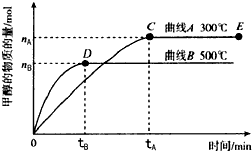

| A、平衡常数K(300℃)小于K(500℃) | ||
| B、在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大 | ||
| C、300℃,当容器内气体密度不变时说明反应已经达到平衡 | ||
D、500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
|
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:A.温度越高,甲醇的物质的量越少,根据K=
判断;
B.物质的量不变,体积减小,则浓度增大;
C.根据气体的密度等于气体质量和容器体积的比值来判断;
D.先根据图象计算甲醇的平均反应速率,同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比.
| c(CH3OH) |
| c(CO)?c3(H2) |
B.物质的量不变,体积减小,则浓度增大;
C.根据气体的密度等于气体质量和容器体积的比值来判断;
D.先根据图象计算甲醇的平均反应速率,同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比.
解答:
解:A.温度越高,甲醇的物质的量越少,则一氧化碳和氢气的物质的量越多,根据K=
判断知,平衡常数越小,所以K(500℃)<K(300℃),故A错误;
B.在其他条件下不变时,压缩处于E点的体系体积,氨气浓度增大,故B正确;
C.容器内气体密度ρ=
,体积V不变,M守恒,密度始终不变,所以密度不变时不能说明反应已经达到平衡,故C错误;
D.500℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
mol/(L?min),同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比,所以v(H2)=
mol/(L?min),故D错误;
故选B.
| c(CH3OH) |
| c(CO)?c3(H2) |
B.在其他条件下不变时,压缩处于E点的体系体积,氨气浓度增大,故B正确;
C.容器内气体密度ρ=
| m |
| V |
D.500℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
| nB |
| 3tB |
| 2nB |
| 3tB |
故选B.
点评:本题考查了物质的量随时间变化曲线,根据压强和温度对化学平衡的影响、反应速率公式等来分析解答,易错选项是C,注意增大压强时,平衡向正反应方向移动,但氢气、一氧化碳浓度增大,为易错点.

练习册系列答案
相关题目
茶多酚(Tea Polyphenols)是茶叶中多酚类物质的总称.茶多酚中的活性物质没食子儿茶素(EGC)具解毒和抗辐射作用,能有效地阻止放射性物质侵入骨髓,其结构如图所示.关于EGC的下列叙述中正确的是:( )

| A、分子中所有的原子共面 |
| B、1 mol EGC与4 mol NaOH恰好完全反应 |
| C、遇Fe发生显色反应 |
| D、易发生氧化反应和取代反应,相对较难发生加成反应 |
25℃某浓度的盐酸、氯化铵溶液中水电离出的氢离子浓度分别为1.0×10-amol?L-1、1.0×10-bmol?L-1,则这两种溶液的pH之和为( )
| A、14-a+b |
| B、14+a+b |
| C、14-a-b |
| D、14+a-b |
下列事实不能用勒夏特列原理解释的是( )
| A、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| B、高压比常压有利于合成SO3的反应 |
| C、红棕色的NO2,加压后颜色先变深后变浅 |
| D、黄绿色的氯水光照后颜色变浅 |
下列比较中,正确的是( )
| A、等温等物质的量浓度溶液中,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol/L NH4Cl溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、同浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
聚丙烯酸钠( )具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
 )具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )| A、聚丙烯酸钠属于混合物 |
| B、聚丙烯酸钠属于天然有机高分子化合物 |
| C、聚丙烯酸钠可用于生产“尿不湿” |
| D、路面喷洒聚丙烯酸钠溶液能抑制扬尘,一定程度上能预防雾霾和PM2.5 |
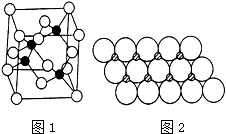 Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题:
Ⅰ.砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少.已知砷化镓的晶胞结构如图1所示.请回答下列问题: