题目内容
11.如表为元素周期表的一部分,其中A、X、Y、W、Z为短周期元素,W元素的核电荷数为X元素的2倍.据此,下列说法中错误的是( )| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-═2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
分析 A、X、Y、W、Z为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,可知Y为Si、Z为P、T为As,A为Cl,B为Br,结合元素周期律与元素化合物结构与性质解答.
解答 解:A、X、Y、W、Z为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,可知Y为Si、Z为P、T为As,A为Cl,B为Br,
A.非金属性X>W>Z,对应气态氢化物的热稳定性变化减弱;电子层越多原子半径越大,则原子半径为Z>W>X,故A正确;
B.非金属性Y、Z、W、A逐渐增强,对应最高价氧化物的水化物的酸性依次递增,但是Y、Z、W、A四种元素中S可以单质形式存在,而硅是亲氧元素,以化合态硅酸盐、二氧化硅的形式存在,故B错误;
C.电解A的钠盐如氯化钠溶液,生成NaOH、氢气、氯气,阳极氯离子失去电子被氧化成氯气,其阴极反应式为:2H2O+2e-=2OH-+H2↑,阴极产生NaOH,为使钠离子向阴极移动,选阳离子交换膜,产生的氢气与氯气不能通过阳离子交换膜,避免了产物互相反应,故C正确;
D.As位于金属与非金属性的交界处,则T元素的单质具有半导体特性,As的化合价为+3价时为中间价态,则T2X3具有氧化性和还原性,故D正确;
故选:B.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意W、X为元素推断的突破口,注意硅是亲氧元素,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列表示物质结构的化学用语或模型正确的是( )
| A. | 羟基的电子式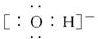 | B. | CH4分子的球棍模型 | ||
| C. | 乙烯的最简式(实验式) CH2 | D. | 苯乙醛结构简式 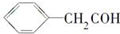 |
6.铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A. | T1(OH)3是两性氢氧化物 | B. | 铊与酸反应比铝更剧烈 | ||
| C. | Tl3+的氧化能力比Al3+弱 | D. | 铊是易导电的银白色金属 |
16.Al与Na2O2的混合物溶于足量的水中,得到澄清溶液,同时产生3.5g气体.在所得溶液与100mL 7mol/L盐酸作用过程中,先有白色沉淀生成,此后沉淀又恰好溶解,则Al与Na2O2的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 11:2 | D. | 2:11 |
6.某学生做葡萄糖的还原性实验,取了1mol•L-1 CuSO4溶液和0.5mol•L-1 NaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入1mL 40%的葡萄糖溶液,加热煮沸,但始终无砖红色沉淀出现.实验失败的原因可能是( )
| A. | 未充分加热 | B. | 加入葡萄糖太多 | ||
| C. | 加入NaOH溶液的量不够 | D. | 加入CuSO4溶液的量不够 |

 .
.