题目内容
3.通过海水晾晒可得粗盐.粗盐除主要含NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质.为了有效将粗盐提纯,实验的各步操作流程如图所示.根据如图信息回答:
(1)在完成操作Ⅰ之前,必须加入的X物质是水.
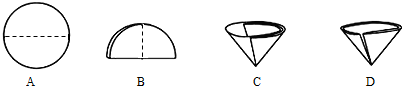
(2)操作Ⅰ和操作Ⅱ的名称是过滤.该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是D(填序号).
(3)在蒸发操作中容易造成食盐水飞溅,为尽量减少液体飞溅,除连续搅拌外还可采取间歇加热(或“来回移动酒精灯或蒸发皿”)等措施.(填任意一种即可)
(4)在实验过程中加入过量的NaOH溶液,其实验目的是除尽溶液中的镁离子.
(5)判断加入的盐酸“适量”的方法是滴加盐酸至无气泡放出为止.
(6)实验所得精盐的质量大于(填“大于”、“小于”或“等于”)粗盐中NaCl的质量,原因是提纯的过程中有氯化钠生成.
分析 粗盐除主要含NaCl外,还含有MgCl2、CaCl2适量l2以及泥沙等杂质,加入X为水溶解通过操作Ⅰ过滤得到溶液中加入Ⅰ过量氢氧化钠溶液,沉淀镁离子再加入过量碳酸钠溶液沉淀钙离子,操作Ⅱ过滤得到溶液中加入适量盐酸到不再生成气体,得到氯化钠溶液蒸发浓缩得到精盐,
(1)操作Ⅰ为过滤,粗盐为固体,过滤前必须加水将粗盐配成溶液;
(2)操作Ⅰ和Ⅱ是将不溶物与溶液分离,操作方法为过滤;折叠后的滤纸不能出现缝隙;
(3)加热时温度不宜过高,否则容易飞溅,据此判断操作方法;
(4)氢氧化钠与镁离子反应生成氢氧化镁沉淀,从而除去杂质镁离子;
(5)碳酸钠与氯化氢反应生成二氧化碳气体,可以据此判断盐酸是否过量;
(6)提纯过程中有生成的氯化钠,所以精盐的质量大于粗盐氯化钠的质量.
解答 解:(1)海水晾晒得到的粗盐是固体,要进行提纯,需要先加水配成溶液,
故答案为:水;
(2)分离固体与溶液的方法是过滤;I、II都是分理处沉淀的过程.滤纸对折再对折然后打开,不能有缝隙,所以D错误,
故答案为:过滤;D;
(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,可连续搅拌,还可采取间歇加热(或“来回移动酒精灯)的方法,
故答案为:间歇加热(或“来回移动酒精灯或蒸发皿”);
(4)加入过量的氢氧化钠,氢氧根离子可以和镁离子转化为氢氧化镁沉淀而将镁离子除去,
故答案为:除尽溶液中的镁离子;
(5)此步操作的目的是除去多余的碳酸钠、氢氧化钠,而盐酸与碳酸钠反应是有气泡产生,从是否产生气泡可以判断盐酸的过量情况,
故答案为:滴加盐酸至无气泡放出为止;
(6)在粗盐提纯的过程中,碳酸钠、氯化钙、氯化镁、氢氧化钠等物质参加反应生成了氯化钠,所以实验所得精盐的质量大于粗盐中NaCl的质量,
故答案为:大于;提纯的过程中有氯化钠生成.
点评 本题考查了粗盐的提纯方法,题目难度中等,注意掌握提纯过程中除杂试剂的选用方法、实验操作方法,明确除杂原则是解答本题的关键,除去多种杂质时,要考虑加入试剂的顺序;试题培养了学生灵活应用所学知识能力.

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案| A. | NH3、H2、C2H6 | B. | H2O、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、SiC、H2O2 |
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 充电电池可以无限制地反复使用 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 废旧电池不能乱扔,需回收处理 |
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-═2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
①取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;
②一份中加入AgNO3溶液,有白色沉淀产生;
③另一份加入BaCl2溶液,有白色沉淀产生.
则该溶液中一定大量存在的离子组是( )
| A. | Na+、Fe3+、SO42- | B. | CO32-、Cl-、SO42- | C. | Ca2+、Br-、SO42- | D. | Na+、SO42-、CO32- |
| A. | 向铝盐溶液中不断加入偏铝酸钠溶液 | |
| B. | 向盐酸中不断加入偏铝酸钠溶液 | |
| C. | 向氢氧化钠溶液中加铝盐溶液 | |
| D. | 向偏铝酸盐中下断加入盐酸 |
| A. | 氧族元素包括氧、硫、锡、碲、钋 | |
| B. | Na2O2固体中的阳离子和阴离子个数比为1:1 | |
| C. | H、D、T、H+可以用来表示氢元素的四种同位素 | |
| D. | 表示金属元素名称的汉字不一定都含“钅”旁 |
①碳与二氧化碳化合
②胆矾失水
③Zn与稀硫酸反应
④氯酸钾分解制氧气
⑤Ba(OH)2•8H2O与NH4Cl反应
⑥甲烷与氧气的燃烧.
| A. | ①②④③ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ①④③ |
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 甲烷、乙烯和苯的分子中原子都在同一平面上 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | 乙烯和甲烷不能用溴的四氯化碳溶液鉴别 |