题目内容
9.三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用(1)在如图1所示装置中进行氮的催化氧化实验:向三颈瓶内的浓氨气中不断通入空气,将红热的铂丝插入瓶中并接近液面,反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热.实验过程中NH3•H2O的电离程度变大(填“变大”、“变小”或“不变”)
(2)实验室用如图2所示装置制备氨基甲酸铵(NH2COONH4),其反应的化学方程式为:2NH3(g)+CO2(g)?NH2COONH4(g)
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
①写出加入药品之前实验操作的要点按图所示组装仪器,检查装置气密性;反应中若有水存在则生成碳酸氢铵的化学方程式:NH3+CO2+H2O=NH4HCO3
②干燥管中盛放的药品是氧化钙或固体氢氧化钠或碱石灰,简述左侧三劲瓶装置制取氨气的原理固体氢氧化钠遇水放出大量热,温度升高,有利于氨气逸出,同时C(OH-)浓度增大,氨水的电离平衡左移,放出氨气
③对比碳酸盐的反应制CO2,该实验利用于升华产生CO2气体的优点有不需要干燥;提供低温环境,提高转化率
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是产品易堵塞导管,稀硫酸会倒吸
⑤氨基甲酸铵可用作肥料,其肥料比尿素[CO(NH2)2]低(填“高”或“低”),在潮湿的空气中释放处氨而变成碳酸氢铵,取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥、测得质量为1.000g,则样品中氨基甲酸按的物质的量分数为70%
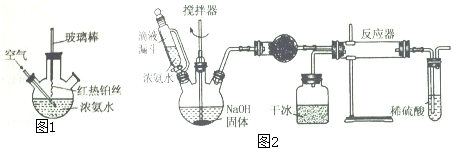
分析 (1)浓氨水受热分解生成氨气,氨气与空气中的氧气在铂丝催化条件下生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,铂丝始终保持红热说明反应是放热反应,氨水浓度减小,所以NH3•H2O的电离程度变大;
(2)①分析装置图可知,气体反应过程来制备物质,需要组装好仪器后,检查装置气密性;有水会和氨气、二氧化碳反应生成碳酸氢钠;
②反应物氨气必须是干燥的,需要用碱性干燥剂干燥,如碱石灰、固体氢氧化钠或氧化钙等;利用固体氢氧化钠或碱石灰或氧化钙固体溶解放热分析;
③干冰制取的二氧化碳中不含杂质,不需要干燥;该反应为放热反应,干冰变为二氧化碳吸收热量,有利于增大反应物转化率;
④依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸;
⑤氨基甲酸铵可用作肥料,其肥效和尿素比,依据计算的氮元素含量分析;碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳元素守恒和混合物质量计算物质的量分数.
解答 解:(1)浓氨水受热分解生成氨气,氨气与空气中的氧气在铂丝催化条件下生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,方程式依次为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,铂丝始终保持红热说明反应是放热反应,氨水浓度减小,所以NH3•H2O的电离程度变大;
故答案为:变大;
(2)①分析装置图可知,是利用气体反应制备物质,加入药品之前实验操作的要点是按图组装好仪器,检查装置气密性;有水会和氨气、二氧化碳反应生成碳酸氢钠,反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;
故答案为:按图所示组装仪器,检查装置气密性,NH3+CO2+H2O=NH4HCO3;
②由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥,因为氨气是碱性气体,所以干燥氨气应该用氧化钙或固体氢氧化钠或碱石灰,固体氢氧化钠遇水放出大量热,温度升高,有利于氨气逸出,同时C(OH-)浓度增大,氨水的电离平衡左移,放出氨气;
故答案为:氧化钙或固体氢氧化钠或碱石灰;固体氢氧化钠遇水放出大量热,温度升高,有利于氨气逸出,同时C(OH-)浓度增大,氨水的电离平衡左移,放出氨气;
③碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率;
故答案为:不需要干燥;提供低温环境,提高转化率;
④依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸,实验装置存在安全问题产品易堵塞导管,稀硫酸会倒吸;
故答案为:产品易堵塞导管,稀硫酸会倒吸;
⑤氨基甲酸铵可用作肥料,含氮量=$\frac{2×14}{78}$×100%=35.9%,尿素含氮量=46.7%,所以其肥效比尿素低;
取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.物质的量为0.010mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,则
x+y=0.01
78x+79y=0.7830
解得x=0.007mol
y=0.0023ol
则样品中氨基甲酸铵的物质的量分数=$\frac{0.007mol}{0.01mol}$×100%=70%,
故答案为:低;70%.
点评 本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.

| A. |  | B. |  | ||
| C. |  | D. |  |
下列说法不正确的是( )
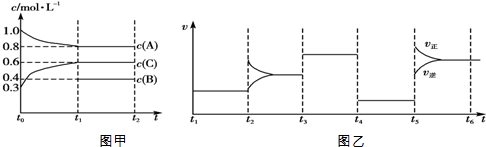
| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
| A. | H2+2OH-=2H2O+2e- | B. | O2+4H++4e-=2H2O | ||
| C. | H2-2e-=2H+ | D. | O2+2H2O+4e-=4OH- |
| A. | 正戊烷<异戊烷<新戊烷 | B. | 正戊烷>新戊烷>异戊烷 | ||
| C. | 邻二甲苯>间二甲苯>对二甲苯 | D. | 邻二甲苯<间二甲苯<对二甲苯 |

 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.