题目内容
1.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电.电池负极反应为( )| A. | H2+2OH-=2H2O+2e- | B. | O2+4H++4e-=2H2O | ||
| C. | H2-2e-=2H+ | D. | O2+2H2O+4e-=4OH- |
分析 氢氧燃料电池中,负极上通入氢气,氢气失电子发生氧化反应,正极上通入氧化剂,氧化剂得电子发生还原反应,据此分析解答.
解答 解:氢氧燃料电池中,负极上通入氢气,氢气失电子发生氧化反应,正极上通入氧化剂,氧化剂得电子发生还原反应,酸性介质中,负极上氢气失电子生成氢离子,电极反应式为H2-2e-=2H+,正极上氧化剂氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,故选C.
点评 本题考查燃料电池电极反应式的书写,为高考高频点,燃料电池中负极上燃料失电子、正极上氧化剂得电子,常见燃料电池介质类型有:酸性介质、碱性介质、熔融氧化物介质、熔融碳酸盐介质,题目难度中等.

练习册系列答案
相关题目
4.下列递变规律不正确的是( )
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | F、Cl、Br、I原子半径依次增大 | D. | N、O、F最高正价依次升高 |
16.孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物.以孔雀石为原料可制备CuCl2•3H2O及纯碱,流程如图.
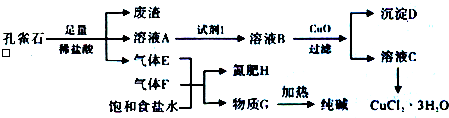
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示.回答下列问题:
(1)孔雀石研磨的目的是增大固体表面积,从而增大反应速率.
(2)孔雀石的主要成分与足量稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用BD(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离.则pH的范围为3.2≤pH<4.7.
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是F、NH3(填代号及对应物质的化学式).
(6)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(7)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.

且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示.回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| PH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)孔雀石的主要成分与足量稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用BD(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离.则pH的范围为3.2≤pH<4.7.
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是F、NH3(填代号及对应物质的化学式).
(6)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(7)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.
13.已知Fe(s)+H2SO4(aq)=FeSO4(aq)+H2(g)△H<0,则下列关于该反应的叙述不正确的是( )
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量有关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 此反应构成的原电池中,正极可以是碳棒、铜或锌 |
10.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中只以化合态的形式存在 | B. | 单质常用作光导纤维 | ||
| C. | 最高价氧化物不与酸反应 | D. | 气态氢化物比甲烷稳定 |
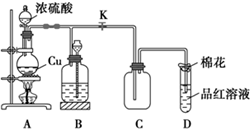 (1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.

 (1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑