题目内容
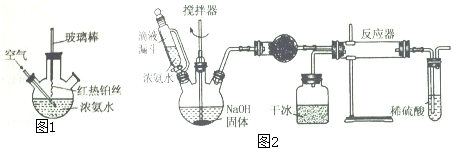
4.硝酸是一种重要的化工原料,氨氧化法是工业生产中制取硝酸的主要途径,某兴趣小组在实验室模拟氨氧化法制硝酸,实验装置如图所示,回答下列问题:(注:氯化钙可以与NH3反应生成八氨合氯化钙.)(1)仪器a的名称为球形干燥管,其中加的试剂为碱石灰.
(2)实验时先点燃C中的酒精灯,当催化剂Cr2O3由暗绿色变为微红时通入空气,3min后Cr2O3出现暗红色,移去酒精灯,Cr2O3能保持红热状态的原因是该反应放热,装置C中发生反应的总反应化学方程式为4NH3+5O2$\frac{\underline{\;三氧化二铬\;}}{△}$4NO+6H2O.
(3)装置D的作用是除去氨气和水蒸气;装置G的作用是吸收尾气.
(4)反应开始后,在装置E中看到的现象是气体变为红棕色.
(5)实验结束后,证明有HNO3生成的操作是取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生产.
(6)为测定所制硝酸的浓度,反应结束后取20mL 装置F中的液体,加水稀释至1000mL后,取出20mL加入锥形瓶中,滴加指示剂,然后用0.100mol/L的NaOH溶液滴定,用去25mL的NaOH溶液,则反应制得的硝酸的浓度为6.25 mol/L.

分析 (1)仪器a为球形干燥管,作用是干燥氧气和氨气的混合气体,应选用碱性干燥剂;
(2)移去酒精灯,Cr2O3固体保持红热说明反应放热;
装置C中发生反应的化学反应是氨气的催化氧化反应生成一氧化氮和水;
(3)无水氯化钙是常用的干燥剂,同时氯化钙可以与NH3反应生成八氨合氯化钙;氢氧化钠溶液可以吸收酸性气体;
(4)一氧化氮与空气中的氧气反应生成二氧化氮;
(5)二氧化氮气体与水反应生成硝酸,硝酸遇到石蕊试液变红色;
(6)根据氢氧化钠的物质的量计算硝酸的浓度.
解答 解:(1)仪器a为球形干燥管,作用是干燥氧气和氨气的混合气体,应选用碱性干燥剂碱石灰,
故答案为:球形干燥管,碱石灰;
(2)装置C中发生反应的化学反应是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{\;三氧化二铬\;}}{△}$4NO+6H2O;
移去酒精灯,Cr2O3固体保持红热说明反应放热,
故答案为:该反应放热;4NH3+5O2$\frac{\underline{\;三氧化二铬\;}}{△}$4NO+6H2O;
(3)氯化钙可以与NH3反应生成八氨合氯化钙,无水氯化钙是常用的干燥剂,故可以吸收氨气和水蒸气;装置G中盛放的是氢氧化钠溶液,可以吸收尾气,防治污染环境;
故答案为:除去氨气和水蒸气,吸收尾气;
(4)无色的一氧化氮与空气中的氧气反应生成红棕色的二氧化氮;
故答案为:气体变为红棕色;
(5)二氧化氮气体与水反应生成硝酸,硝酸遇到石蕊试液变红色,故证明有HNO3生成的操作是:取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生产,
故答案为:取少量F中的液体于试管中,滴加几滴紫色石蕊试液,溶液变红,证明有HNO3生产;
(6)反应制得的硝酸的浓度为$\frac{0.100mol/L×25mL}{20mL}$×$\frac{1000mL}{20Ml}$=6.25mol/L,
故答案为:6.25.
点评 本题以氨氧化法制取硝酸为载体考查物质制备的实验探究和物质性质的分析应用,题目难度中等.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 少量铁粉加入AgNO3溶液中 | |
| B. | 少量Na2O2粉末加入CuSO4溶液中 | |
| C. | 少量BaSO4粉末加入饱和Na2CO3溶液中 | |
| D. | 少量Al2(SO4)3粉末加入Ba(OH)2溶液中 |
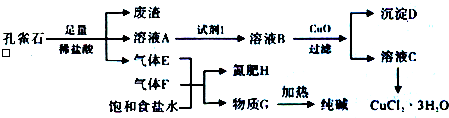
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示.回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| PH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)孔雀石的主要成分与足量稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用BD(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离.则pH的范围为3.2≤pH<4.7.
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是F、NH3(填代号及对应物质的化学式).
(6)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(7)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量有关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 此反应构成的原电池中,正极可以是碳棒、铜或锌 |
| A. | 18个纵横代表18个族,7个主族、8个副族 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共有七个横行代表七个周期 | |
| D. | 第IA族全部是金属元素 |
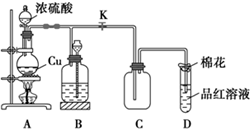 (1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.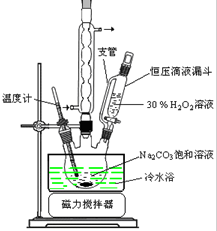 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.