题目内容
18.下列沸点比较正确的是( )| A. | 正戊烷<异戊烷<新戊烷 | B. | 正戊烷>新戊烷>异戊烷 | ||
| C. | 邻二甲苯>间二甲苯>对二甲苯 | D. | 邻二甲苯<间二甲苯<对二甲苯 |
分析 A、同分异构体中支链越多,沸点越低;
B、同分异构体中支链越多,沸点越低;
C、依据苯的同分异构体沸点规律:对称性越好沸点越低;
D、依据苯的同分异构体沸点规律:对称性越好沸点越低.
解答 解:A、同分异构体中支链越多,沸点越低,则正戊烷>异戊烷>新戊烷,故A错误;
B、同分异构体中支链越多,沸点越低,则正戊烷>异戊烷>新戊烷,故B错误;
C、对二甲苯>间二甲苯>邻二甲苯对称性依次减弱,依据称性越好沸点越低,沸点顺序为:对二甲苯<间二甲苯<邻二甲苯,故C正确;
D、对二甲苯>间二甲苯>邻二甲苯对称性依次减弱,依据称性越好沸点越低,沸点顺序为:对二甲苯<间二甲苯<邻二甲苯,故D错误;
故选C.
点评 本题考查沸点的比较,明确物质的关系及比较沸点的方法即可解答,难度不大,注意物理性质的影响是解题的关键,注意加深对相应规律的识记.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
1.已知氧化铜在高温下可分解为氧化亚铜,取3.76g硝酸铜强热一段时间后得到1.52g固体和NO2、O2的混合气体.将该混合气体用水充分吸收,对残留固体及用水吸收后剩余气体的成分的判断正确的是( )
| 选项 | A | B | C | D |
| 剩余固体 | Cu(NO3)2、CuO | Cu2O、CuO | Cu2O、CuO | Cu(NO3)2、Cu2O |
| 剩余气体 | 无气体剩余 | 氧气2.5×10-3mol | NO 2.5×10-3mol | 氧气2.5×10-3mol |
| A. | A | B. | B | C. | C | D. | D |
13.已知Fe(s)+H2SO4(aq)=FeSO4(aq)+H2(g)△H<0,则下列关于该反应的叙述不正确的是( )
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量有关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 此反应构成的原电池中,正极可以是碳棒、铜或锌 |
3.在下列溶液中,各组离子一定能大量共存的是( )
| A. | PH>7的溶液中:K+、AlO2-、Cl-、SO42- | |
| B. | 含有0.1mol/L Fe3+的溶液中:K+、Mg2+、I-、SCN-、HCO3- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 在由水电离产生c(H+)=1×10-13mol/L的溶液中:Na+、S2O32-、Fe3+、NO3- |
10.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中只以化合态的形式存在 | B. | 单质常用作光导纤维 | ||
| C. | 最高价氧化物不与酸反应 | D. | 气态氢化物比甲烷稳定 |
7.下列微粒间的作用力中,不属于化学键的是( )
| A. | 分子间作用力 | B. | 金属键 | C. | 共价键 | D. | 离子键 |
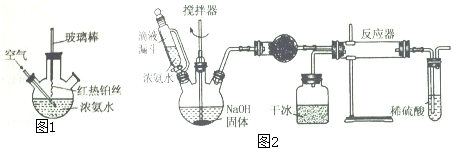

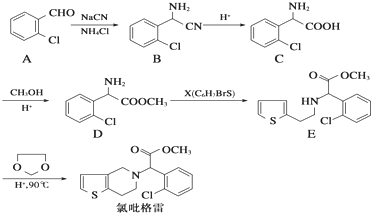 ,
, .
.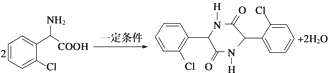 .
.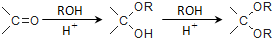 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物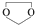 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物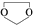 的最后一步反应
的最后一步反应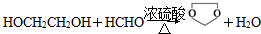 .
.