题目内容
13.某亚硫酸钠试样暴露在空气中,部分已被氧化成硫酸钠.经测定,试样中硫元素的质量分数为25%.(1)写出发生变化的化学方程式:2Na2SO3+O2=2Na2SO4.
(2)求混合物中亚硫酸钠与硫酸钠的物质的量之比7:1.
分析 (1)亚硫酸钠比氧化生成硫酸钠,反应方程式为:2Na2SO3+O2=2Na2SO4;
(2)由于亚硫酸钠部分为氧化为硫酸钠,样品为Na2SO3、Na2SO4混合物,设二者物质的量分别为xmol、ymol,根据硫元素质量分数列方程计算解答.
解答 解:(1)亚硫酸钠比氧化生成硫酸钠,反应方程式为:2Na2SO3+O2=2Na2SO4,
故答案为:2Na2SO3+O2=2Na2SO4;
(2)由于亚硫酸钠部分为氧化为硫酸钠,样品为Na2SO3、Na2SO4混合物,设二者物质的量分别为xmol、ymol,则:32(x+y)=(126x+142y)×25%,整理得x:y=7:1,
故答案为:7:1.
点评 本题考查化学方程式书写、混合物计算,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
4.下列递变规律不正确的是( )
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | F、Cl、Br、I原子半径依次增大 | D. | N、O、F最高正价依次升高 |
1.已知氧化铜在高温下可分解为氧化亚铜,取3.76g硝酸铜强热一段时间后得到1.52g固体和NO2、O2的混合气体.将该混合气体用水充分吸收,对残留固体及用水吸收后剩余气体的成分的判断正确的是( )
| 选项 | A | B | C | D |
| 剩余固体 | Cu(NO3)2、CuO | Cu2O、CuO | Cu2O、CuO | Cu(NO3)2、Cu2O |
| 剩余气体 | 无气体剩余 | 氧气2.5×10-3mol | NO 2.5×10-3mol | 氧气2.5×10-3mol |
| A. | A | B. | B | C. | C | D. | D |
8.下列物质反应后经过过滤,反应液质量增大的是( )
| A. | 少量铁粉加入AgNO3溶液中 | |
| B. | 少量Na2O2粉末加入CuSO4溶液中 | |
| C. | 少量BaSO4粉末加入饱和Na2CO3溶液中 | |
| D. | 少量Al2(SO4)3粉末加入Ba(OH)2溶液中 |
10.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中只以化合态的形式存在 | B. | 单质常用作光导纤维 | ||
| C. | 最高价氧化物不与酸反应 | D. | 气态氢化物比甲烷稳定 |
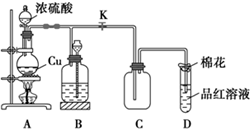 (1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.