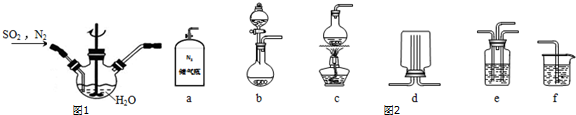
题目内容
11. 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点.
①Ti的基态原子价电子排布式为3d24s2.
②Fe的基态原子共有7种不同能级的电子.
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4═2KCl+2CrO2Cl2+3COCl2↑.
①上述化学方程式中非金属元素电负性由大到小的顺序是O>Cl>C(用元素符号表示).
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为3:1,中心原子的杂化方式为sp2.
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm.则熔点:NiO>(填“>”、“<”或“=”)FeO.
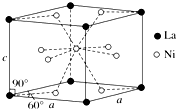
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化.该合金的晶胞结构如图所示.
①该晶体的化学式为LaNi5.
②已知该晶胞的摩尔质量为M g•mol-1,密度为d g•cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是$\frac{M}{{N}_{A}d}$ cm3(用含M、d、NA的代数式表示).
分析 (1)①Ti是22号元素,根据原子核外电子排布规律排布;
②Fe是26号元素,原子核外有spd等能级;
(2)①反应式中非金属元素有三种:O、C、Cl,结合化合物CCl4、NaClO中元素化合价判断;
②根据1个单键是1个δ键,1个双键中含有1个δ键,1个π键以及COCl2分子的结构式来解答;
(3)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(4)①根据均摊法计算晶胞中实际含有的原子个数,确定化学式;
②根据一个晶胞的质量m=ρv计算.
解答 解:(1)①Ti是22号元素,位于元素周期表中第四周期第IVB族,故Ti的基态原子价电子排布式为 3d24s2,故答案为:3d24s2;
②Fe是26号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,故答案为:7;
(2)①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,CrO2Cl2中Cl为+1价,O为-2价,电负性越大,对键合电子吸引力越大,元素相互化合时该元素表现负价,故电负性:O>Cl>C,故答案为:O>Cl>C;
②COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,中心原子C电子对数=3+$\frac{4-1×2-2}{2}$=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(4)①该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点.
所以晶胞实际含有的镍原子为1×1+$\frac{1}{2}$×8=5,晶胞实际含有的镧原子为8×$\frac{1}{8}$=1,所以晶体的化学式LaNi5,故答案为:LaNi5;
②一个晶胞的质量m=$\frac{M}{{N}_{A}}$,根据m=ρv,即v=$\frac{M}{{N}_{A}d}$,故答案为:$\frac{M}{{N}_{A}d}$;
点评 本题综合性较强,考查了晶胞的计算、化学键、核外电子排布、电离能和电负性的含义及应用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案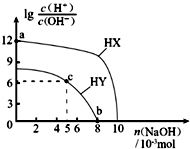 25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )
25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )| A. | 酸性:HX>HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时,溶液pH=7 |
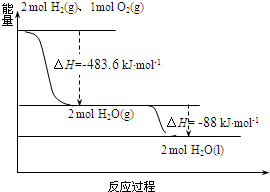
| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量高 | |
| B. | 氢气燃烧的反应为放热反应,故H2与O2混合即可自发进行 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
| A. | 1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA | |
| B. | 28g乙烯和丙烯的混合物中含有双键数目小于NA | |
| C. | 常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH-,0.02NA | |
| D. | 1 L 1 mol/L的甲醇水溶液中含有氢原子总数为4NA |
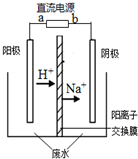 最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )| A. | 电解过程中,阳极附近的乙醛被氧化 | |
| B. | 阳极反应CH3CHO-2e-+H2O═CH3COOH+2H+ | |
| C. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 | |
| D. | 现处理含1mol乙醛的废水,至少需转移2mol电子 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将铜粉加入到浓硫酸中 | 无明显现象 | 铜被浓硫酸钝化 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末 | 产生红褐色沉淀 | 除去MgCl2溶液中的Fe3+ |
| C | 将混有乙酸的乙酸乙酯加入到分液漏斗中,加入氢氧化钠溶液,振荡,静置,分液 | 溶液分层 | 除去乙酸乙酯中的乙酸 |
| D | 分别向两只试管中加入同浓度,同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色时间不同 | 浓度不同反应速率不同 |
| A. | A | B. | B | C. | C | D. | D |
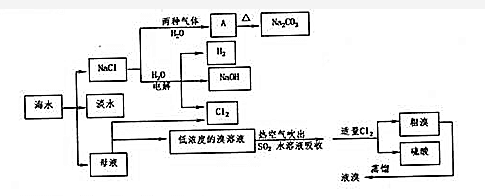
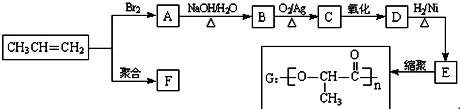
 +2H2O.
+2H2O. .
.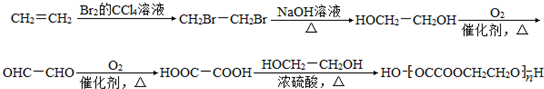 .
.