题目内容
19.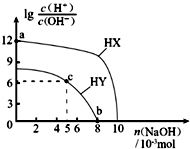 25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )
25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )| A. | 酸性:HX>HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时,溶液pH=7 |
分析 A.由于c(H+)×c(OH-)=Kw,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$越大,溶液中氢离子浓度越大,酸性越强;
B.a点溶液lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=12,结合c(H+)×c(OH-)=10-14计算c(OH-),水电离出的c(H+)等于溶液中c(OH-);
C.c点溶液lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=6,结合c(H+)×c(OH-)=10-14,可知c(H+)=10-4mol/L,溶液呈酸性,此时溶液为等浓度的HY、NaY混合溶液,说明HY的电离程度大于Y-的水解程度;
D.b点时,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,溶液中的c(H+)=c(OH-).
解答 解:A.未加氢氧化钠时,相同浓度溶液中,HX的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=12,而HY的lg$\frac{c({H}^{+})}{c(O{H}^{-})}$<9,由于c(H+)×c(OH-)=Kw,则HX溶液中氢离子浓度更大,故HX的酸性强于HY,故A正确;
B.a点溶液lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=12,结合c(H+)×c(OH-)=10-14,可知c(OH-)=10-13 1mol/L,水电离出的c(H+)等于溶液中c(OH-),即a点由水电离出的c(H+)=10-13 mol?L-1,故B错误;
C.c点溶液lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=6,结合c(H+)×c(OH-)=10-14,可知c(H+)=10-4mol/L,溶液呈酸性,此时溶液为等浓度的HY、NaY混合溶液,说明HY的电离程度大于Y-的水解程度,则溶液中c点溶液中:c(Y-)>c(HY),故C正确;
D.b点时,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,溶液中的c(H+)=c(OH-),常温下溶液呈中性,pH=7,故D正确.
故选B.
点评 本题考查酸碱混合溶液酸碱性判断及溶液中离子浓度大小比较,涉及盐类的水解和弱酸的电离等,题目难度中等,侧重于考查学生的分析能力和计算能力.

| A. | 平衡向正反应方向移动 | B. | m+n<p | ||
| C. | 气体A的转化率升高 | D. | C气体的体积分数增大 |
| A. | 向该溶液中加入过量NaOH溶液,仍能大量存在:ClO-、K+、CO32-、Cl- | |
| B. | 用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+ | |
| C. | 向该溶液中加入过量Ba(OH)2溶液,有白色沉淀生成2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 将该溶液蒸干、灼烧得到是K 2SO4和Al2O3 |
| X | Y | Z |
| W | ||
| T |
| A. | Y、W、T元素的原子半径及它们气态氢化物的还原性均依次递增 | |
| B. | Z氢化物的沸点一定比 X氢化物的沸点高 | |
| C. | X、Y元素形成的常见单质的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在化学式为T2Z3、X3Y4的两种物质,T元素存在同素异形现象 |
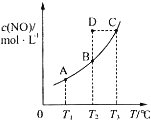 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g)+Q,平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
| A. | 该反应的Q>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时V正>V逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB |
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为  |
(1)A与溴的四氯化碳溶液反应的产物的名称为1,2-二溴乙烷.
(2)B具有的性质是②③⑦(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n=4,x=8.

 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.