题目内容
8.下列有关离子方程式正确的是( )| A. | 向稀盐酸中加入少量金属钠:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 向氯化铁溶液中滴加碳酸氢钠溶液:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| C. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| D. | 将过量的SO2通入漂白粉溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+2Cl-+4H++SO42- |
分析 A.钠优先与氢离子反应,钠少量,则不会与水反应;
B.碳酸氢钠电离出碳酸氢根离子,碳酸氢根离子不能拆开;
C.氢氧化钾过量,碳酸氢根离子也参与反应;
D.二氧化硫过量,次氯酸根离子完全反应.
解答 解:A.向稀盐酸中加入少量金属钠,反应生成氯化钠和氢气,正确的离子方程式为:2Na+2H+═2Na++H2↑,故A错误;
B.向氯化铁溶液中滴加碳酸氢钠溶液,碳酸氢根离子不能拆开,正确的离子方程式为:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑,故B错误;
C.NH4HCO3溶液与过量KOH浓溶液共热,反应生成碳酸钾、氨气和水,反应的离子方程式为:OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故C错误;
D.将过量的SO2通入漂白粉溶液中,二者发生氧化还原反应,反应的离子方程式为:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+2Cl-+4H++SO42-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
15.pH=1的盐酸与pH=12的NaOH溶液混合,要使溶液呈中性.盐酸与NaOH溶液的体积比为( )
| A. | 1:10 | B. | 1:20 | C. | 5:1 | D. | 10:1 |
16.医学上通过研究并实现了利用含放射性元素32P的“纸贴”治疗疤痕疙瘩,下列有关32P和31P的叙述正确的是( )
| A. | 32P和31P属于同一种核素 | B. | 32P的原子中所含的质子数为16 | ||
| C. | 31P的中子数为16 | D. | 32P的摩尔质量为32 |
13.如图所示的有机物转化关系.下列说汰中正确的是( )
(C6H10O5)n$\stackrel{①}{→}$葡萄糖$\stackrel{②}{→}$乙醇$\stackrel{③}{→}$乙酸乙醇.
(C6H10O5)n$\stackrel{①}{→}$葡萄糖$\stackrel{②}{→}$乙醇$\stackrel{③}{→}$乙酸乙醇.
| A. | (C6H10O5)n可表示麦芽糖或淀粉 | |
| B. | 反应②的产物除了乙醇还有一种直线型分子 | |
| C. | 反应①③属于加成反应且所用的催化剂相同 | |
| D. | 乙酸乙酯的同分异构体(不含本身)中能与NaOH溶液反应的有4种 |
3.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为HCO3-+H2O?H2CO3+OH-乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3.丙同学认为甲、乙的判断都不充分.丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于(填“高于”、“低于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和bmol/L,则a与b的具体关系是a=10-4b
(4)25℃时,浓度均为0.3mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是C
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大.
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于(填“高于”、“低于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和bmol/L,则a与b的具体关系是a=10-4b
(4)25℃时,浓度均为0.3mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是C
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大.
17.对于有机物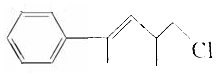 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )
 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )| A. | 分子式是C12H15Cl,属于卤代烃 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 既能使溴水褪色,又能使KMnO4 酸性溶液褪色 | |
| D. | 该溶液与酸化的AgNO3 溶液混合时会产生白色沉淀 |
18.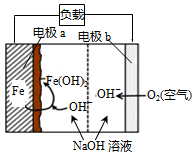 美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H2O═2Fe(OH)2.有关该电池放电时的说法正确的是( )
美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H2O═2Fe(OH)2.有关该电池放电时的说法正确的是( )
 美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H2O═2Fe(OH)2.有关该电池放电时的说法正确的是( )
美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H2O═2Fe(OH)2.有关该电池放电时的说法正确的是( )| A. | a 极质量不变 | B. | b极为电池负极 | ||
| C. | 电子由a极经负载流向b极 | D. | 由电能转变为化学能 |
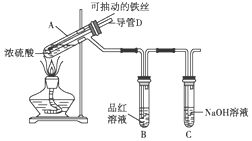 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.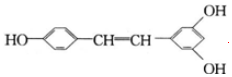 )广泛存在于食物(例如桑葚、花生、尤其是葡萄)中,它可能具有抗癌性,能够跟1mol该化合物起反应的Br2和H2的最大用量分别是6mol、7mol.
)广泛存在于食物(例如桑葚、花生、尤其是葡萄)中,它可能具有抗癌性,能够跟1mol该化合物起反应的Br2和H2的最大用量分别是6mol、7mol.