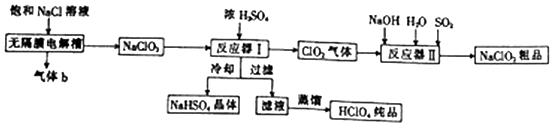
题目内容
15.pH=1的盐酸与pH=12的NaOH溶液混合,要使溶液呈中性.盐酸与NaOH溶液的体积比为( )| A. | 1:10 | B. | 1:20 | C. | 5:1 | D. | 10:1 |
分析 pH=1的盐酸中氢离子浓度为0.1mol/L,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,混合后溶液显中性,则n(H+)=n(OH-),设出溶液体积,然后列式计算出盐酸与NaOH溶液的体积比.
解答 解:pH=1的盐酸中c(H+)=0.1mol/L,pH=12的NaOH溶液中c(OH-)=0.01mol/L,混合后溶液显中性,则n(H+)=n(OH-),设盐酸、氢氧化钠溶液体积分别为x、y,则:0.1x=0.01y,整理可得x:y=1:10,
故选A.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.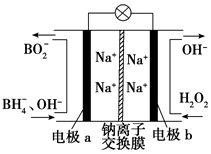 据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
 据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 每消耗1 mol H2O2,转移的电子为1 mol | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 该电池的正极反应为BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 电池放电时Na+从b极区移向a极区 |
3.下列对Na2CO3的分类,不正确的是( )
| A. | Na2CO3是有机物 | B. | Na2CO3是碳酸盐 | ||
| C. | Na2CO3是钠盐 | D. | Na2CO3是易溶性盐 |
10.下列关于物质的分类中正确的是( )
| A. |  卤代烃 | B. |  羧酸 羧酸 | C. |  醛 | D. |  醇 |
20.下列关于元素周期表的叙述中正确的是 ( )
| A. | 元素周期表有7个周期和18个族 | |
| B. | 由短周期元素和长周期元素共同组成的族一定是主族 | |
| C. | 从左向右数第13列是第ⅢB族 | |
| D. | 元素周期表中0族元素的单质全部是气体 |
7.下列物质中,既能发生氧化反应,又能发生还原反应,还能发生水解反应的是( )
| A. | CH2═CH2 | B. | CH3CH2CHO | C. | CH3COOH═CH2 | D. | CH3CH(OH)CH3 |
8.下列有关离子方程式正确的是( )
| A. | 向稀盐酸中加入少量金属钠:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 向氯化铁溶液中滴加碳酸氢钠溶液:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| C. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| D. | 将过量的SO2通入漂白粉溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+2Cl-+4H++SO42- |