题目内容
3.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于(填“高于”、“低于”或“等于”)8.3,则甲(填“甲”或“乙”)判断正确.
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和bmol/L,则a与b的具体关系是a=10-4b
(4)25℃时,浓度均为0.3mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是C
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大.
分析 NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,加热时,NaHCO3可分解生成Na2CO3,Na2CO3水解程度较大,溶液碱性较强;
(1)加入氯化钡溶液后,如生成沉淀,说明乙同学结论正确;
(2)将加热后的溶液冷却到10℃,若溶液的PH等于8.3,说明碳酸氢钠没有分解;
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,NaOH抑制水的电离,碳酸钠促进水解的电离,c(OH-)分别为10-9mol/L、10-5mol/L;
(4)A.均存在水的电离平衡、弱酸根离子水解平衡;
B.水解后溶液中离子种类相同;
C.等浓度时碳酸钠的水解程度大;
D.加入NaOH固体,前者抑制碳酸根离子的水解,后者碳酸氢钠与NaOH反应生成碳酸钠.
解答 解:NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,加热时,NaHCO3可分解生成Na2CO3,Na2CO3水解程度较大,溶液碱性较强,
故答案为:HCO3-+H2O?H2CO3+OH-;大于;
(1)加入氯化钡溶液后,如生成沉淀,说明溶液中存在大量的CO32-,乙同学结论正确,而加入A、D都生成沉淀,不能正确,加入C无现象,故答案为:乙;B;
(2)将加热后的溶液冷却到10℃,若溶液的PH等于8.3,说明碳酸氢钠没有分解,则甲正确,故答案为:等于;甲;
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,NaOH抑制水的电离,碳酸钠促进水解的电离,c(OH-)分别为10-9mol/L、10-5mol/L,则a与b的具体关系是a=10-4b,故答案为:a=10-4b;
(4)A.均存在水的电离平衡、弱酸根离子水解平衡,存在水解、电离平衡,故A正确;
B.水解后溶液中离子种类相同,均含5种离子,故B正确;
C.等浓度时碳酸钠的水解程度大,则c(OH-)前者大于后者,故C错误;
D.加入NaOH固体,前者抑制碳酸根离子的水解,后者碳酸氢钠与NaOH反应生成碳酸钠,则c(CO32-)均增大,故D正确;
故答案为:C.
点评 本题考查盐类水解,为高频考点,把握水解规律、水解平衡移动为解答的关键,侧重分析与应用能力的考查,注意影响水解的因素,题目难度不大.

| A. |  卤代烃 | B. |  羧酸 羧酸 | C. |  醛 | D. |  醇 |
| A. |  蒸馏烧瓶 | B. |  冷凝管 | C. |  蒸发皿 | D. |  分液漏斗 |
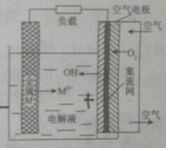 金属燃料电池是一类特殊的燃料电池.具有成本低、无毒、无污染、比功率高、比能量高等优点,电池的基本结构如图,锌、铁、镁、铝等金属都可以用在金属燃料电池中.下列说法不正确的是( )
金属燃料电池是一类特殊的燃料电池.具有成本低、无毒、无污染、比功率高、比能量高等优点,电池的基本结构如图,锌、铁、镁、铝等金属都可以用在金属燃料电池中.下列说法不正确的是( )| A. | 电池工作时.金属M电极皱氧化.发生氧化反应 | |
| B. | 电池工作时.空气电极反应式为O2+4e-+2H2O=4OH | |
| C. | 电池工作时.OH-向负极移动,负极附近溶液的pH增大 | |
| D. | 若M为锌,电池反应方程式为2Zn+2H2O+O2=2Zn(OH)2 |
| A. | 向稀盐酸中加入少量金属钠:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 向氯化铁溶液中滴加碳酸氢钠溶液:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| C. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| D. | 将过量的SO2通入漂白粉溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+2Cl-+4H++SO42- |
| A. | X是乙烯 | B. | X能使溴水褪色 | ||
| C. | X属于不饱和烃 | D. | X的二氯代物有三种 |
| A. |  制取氨气 | B. |  干燥氯气 | C. |  转移溶液 | D. |  萃取溴 |