题目内容
已知NH4Ac溶液呈中性,一种c(H+)=10-3mol/L的酸a和pH=11的氨水b以等体积混合后,溶液呈碱性,关于酸a说法正确的是( )
| A、酸a的浓度可能大于b |
| B、酸a的浓度可能等于b |
| C、酸a的酸性比醋酸弱 |
| D、酸a可能是强酸可能是弱酸 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:c(H+)=10-3mol/L的酸a和pH=11的氨水b以等体积混合后,溶液呈碱性,说明氨水过量,则氨水的浓度大于酸的浓度;据此分析.
解答:
解:c(H+)=10-3mol/L的酸a,pH=11的氨水b中c(OH-)=10-3mol/L,二者等体积混合后,溶液呈碱性,说明反应后氨水又电离出氢氧根离子,即氨水过量,所以氨水的浓度大于酸a的浓度,则酸a的电离程度大于氨水的电离程度,而氨水与醋酸的电离程度相当,所以酸a的电离程度比醋酸大,则酸a的酸性比醋酸强,酸a可能是强酸可能是弱酸,故D正确;
故选D.
故选D.
点评:本题考查了弱酸的电离,主要考查了酸碱混合溶液中酸碱的浓度比较及电离程度的比较,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、将pH=3的醋酸稀释后,溶液中所有离子的浓度均降低 |
| B、在纯水中加入少量NaOH或醋酸钠均可抑制水的电离 |
| C、常温下,将pH=3的盐酸和pH=11的氨水等体积混合,溶液的pH>7 |
| D、用标准NaOH溶液滴定醋酸至刚好完全反应时,溶液中C(Na+)=C(CH3COO-) |
乙烷、乙炔分子中碳原子间的共用电子对数目分别是1、3,则C20H32分子中碳原子间的共用电子对数目可能为( )
| A、20 | B、24 | C、25 | D、77 |
用质量分数为98%、密度为1.84g/cm3的浓硫酸,来配制500mL 1mol/L硫酸溶液,实验遇到下列情况,会使硫酸溶液的物质的量浓度偏高的是( )
| A、未经冷却趁热将溶液注入容量瓶中 |
| B、摇匀后发现液面低于刻度线再加水 |
| C、容量瓶中原有少量蒸馏水 |
| D、定容时仰视观察液面 |
已知强酸和强碱在稀溶液中发生中和反应生成1molH2O(l)时放出57.30kJ热量,用500mL0.60mol/L
H2SO4溶液与200mL5mol/LNaOH溶液完全反应,放出的热量是( )
H2SO4溶液与200mL5mol/LNaOH溶液完全反应,放出的热量是( )
| A、68.76kJ |
| B、57.30 kJ |
| C、34.38kJ |
| D、17.19 kJ |
下列说法不正确的是( )
| A、N2和H2在一定条件下合成氨,可以实现固氮 |
| B、用氨水吸收CO2,可以捕捉碳,降低温室效应 |
| C、对煤炭、石油脱硫,可以减少酸雨 |
| D、PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康.它在空气中为气溶胶 |
分子式为C6H12的烯烃与H2O的加成产物,不能发生催化氧化反应的有(不考虑立体异构)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题: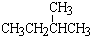 ; ⑧CH3CH2CH2CH3与CH3CH(CH3)2
; ⑧CH3CH2CH2CH3与CH3CH(CH3)2