题目内容
12. 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则95℃时水的电离平衡曲线应为B(填“A”或“B”).请简述判断的理由水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小.
(2)在25℃时,0.01mol/L的NaOH溶液的PH为12;PH为11的Ba(OH)2溶液中Ba(OH)2的物质的量浓度为5×10-4mol/L.
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为10:1.
(4)在95℃时,纯水的PH为6,此温度下将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液为中性,则NaOH溶液与H2SO4溶液的体积比为1:10.
分析 (1)水的电离是吸热过程,降低温度抑制水电离,导致水中c(H+)、c(OH-)都减小;
(2)在25℃时,Kw=10-14,溶液中存在离子积常数,据此计算;
(3)先根据温度和混合溶液pH大小确定溶液的酸碱性,根据溶液的pH计算酸和碱的体积之比;
(4)图中可知.在95℃时,Kw=10-12,c(H+)=10-6mol/L,纯水的PH为6,此温度下将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液为中性,溶液中氢离子物质的量和氢氧根离子物质的量相同.
解答 解:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性,则95℃时水的电离平衡曲线应为B,
故答案为:B;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)在25℃时,0.01mol/L的NaOH溶液中c(OH-)=0.01mol/L,c(H+)=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,溶液PH=12,PH为11的Ba(OH)2溶液中氢氧根离子浓度c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,Ba(OH)2=Ba2++2OH-,Ba(OH)2的物质的量浓度为:5×10-4mol/L,
故答案为:12;5×10-4mol/L;
(3)25°C时纯水的pH=6,混合溶液的pH=7,说明酸、碱混合呈中性,pH=9的NaOH溶液c(OH-)=10-5 mol/L,pH=4的H2SO4溶液(H+)=10-4mol/L,
设酸的体积为x,碱的体积为y,10-5 mol/L×y=10-4mol/L×x,y:x=10:1;
故答案为:10:1;
(4)图中可知.在95℃时,Kw=10-12,c(H+)=10-6mol/L,纯水的PH为6,此温度下将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液为中性,溶液中氢离子物质的量和氢氧根离子物质的量相同,设氢氧化钠溶液体积为V(碱),硫酸溶液体积为V(酸),则得到:$\frac{1{0}^{-14}}{1{0}^{-9}}$×V(碱)=10-4×V(酸),得到V(碱):V(酸)=1:10,
故答案为:6,1:10.
点评 本题考查水的电离和酸、碱混合的pH计算问题,题目难度中等,注意温度不同而使水的离子积常数不同是解本题的关键.

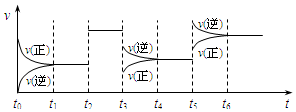 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
(一)制备苯乙烯(原理如反应I所示):
I.
 △H=+124kJ•mol-1
△H=+124kJ•mol-1(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应II所示):
II.
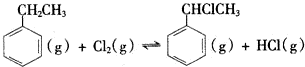 △H2>0
△H2>0(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯和Cl2的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0-5min内,以HC1表示的该反应速率v(HCl)=0.032 mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HCl);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2 表示,则αl<α2(填“>”、“<”或“=”).