题目内容
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源.

(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示).铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2.
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有 mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: .
(6)锌锰干电池所含的汞可用KMnO4溶液吸收,在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图所示:

根据如图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 .
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.

(1)填充物用60℃温水溶解,目的是
(2)操作A的名称为
(3)铜帽溶解时加入H2O2的目的是
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式:
(6)锌锰干电池所含的汞可用KMnO4溶液吸收,在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图所示:

根据如图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验题
分析:(1)加热适当温度,可促进溶解,注意温度不能过高;
(2)操作A用于分离固体和液体;
(3)酸性条件下,双氧水能将铜氧化生成铜离子;加热条件下,双氧水易分解;
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,其负极上锌失电子发生氧化反应;
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①根据二氧化锰和转移电子之间的关系式计算;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水;
(6)根据横坐标与其吸收率曲线变化趋势分析;酸性条件下,高锰酸钾具有强氧化性.
(2)操作A用于分离固体和液体;
(3)酸性条件下,双氧水能将铜氧化生成铜离子;加热条件下,双氧水易分解;
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,其负极上锌失电子发生氧化反应;
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①根据二氧化锰和转移电子之间的关系式计算;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水;
(6)根据横坐标与其吸收率曲线变化趋势分析;酸性条件下,高锰酸钾具有强氧化性.
解答:
解:(1)加热适当温度,可促进溶解,故答案为:加快溶解速率;
(2)分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤,故答案为:过滤;
(3)酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O; 加热;
(4)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OH--2e-=Zn(OH)2,故答案为:Zn+2OH--2e-=Zn(OH)2;
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2 MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①该反应中,氧化剂是MnO(OH)、MnO2,还原剂是草酸,当1mol MnO2参加反应时,转移电子的物质的量=
×2×2×(4-3)=4mol,故答案为:4;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水,反应方程式为:2MnO(OH)+6HCl(浓)
2MnCl2+Cl2↑+4H2O,
故答案为:2MnO(OH)+6HCl(浓)
2MnCl2+Cl2↑+4H2O;
(6)①根据图象知,随着pH的增大,汞的吸收率先先降低后增加,故答案为:先降低后增加;
②酸性条件下,高锰酸钾具有强氧化性,所以酸性条件下的高锰酸钾氧化性更强,故答案为:氧化性.
(2)分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤,故答案为:过滤;
(3)酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O; 加热;
(4)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OH--2e-=Zn(OH)2,故答案为:Zn+2OH--2e-=Zn(OH)2;
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2 MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①该反应中,氧化剂是MnO(OH)、MnO2,还原剂是草酸,当1mol MnO2参加反应时,转移电子的物质的量=
| 1mol |
| 1 |
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水,反应方程式为:2MnO(OH)+6HCl(浓)
| ||
故答案为:2MnO(OH)+6HCl(浓)
| ||
(6)①根据图象知,随着pH的增大,汞的吸收率先先降低后增加,故答案为:先降低后增加;
②酸性条件下,高锰酸钾具有强氧化性,所以酸性条件下的高锰酸钾氧化性更强,故答案为:氧化性.
点评:本题考查了物质的分离和提纯、原电池原理,根据原电池正负极上发生的反应、物质的性质及其分离方法来分析解答,能从整体上把握物质分离过程,熟练掌握基础知识,灵活运用知识解答,题目难度中等.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
根据如图,下列判断中正确的是( )
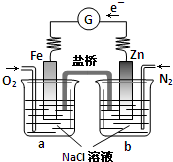

| A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、烧杯b中发生反应为Zn-2e-=Zn2+ |
下列离子方程式中,正确的是( )
| A、氯气通入水中,溶液呈酸性:Cl2+H2O?2H++Cl-+ClO- | ||||
B、用铜做电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| C、NaHS电离方程式:NaHS?Na++HS- | ||||
| D、NH4Cl水解反应:NH4++2H2O?NH3?H2O+H3O+ |


 (5)下列关于化合物I、II、V、VI的说法正确的有
(5)下列关于化合物I、II、V、VI的说法正确的有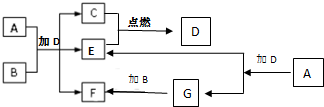 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.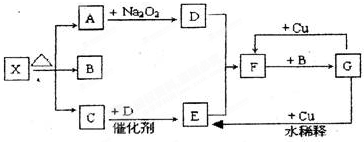
 已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:
已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系: 某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: