题目内容
20.下列有关说法正确的是(NA表示阿伏加德罗常数的值)( )| A. | 标况下,22.4L氯气完全溶于水转移电子数为NA | |
| B. | 32gS完全溶于氢氧化钠溶液转移电子数为2 NA | |
| C. | 标况下,6.72LNO2完全溶于水转移电子数为NA | |
| D. | 28.8g氧化亚铜溶于稀硫酸转移电子数为0.2 NA |
分析 A、氯气和水的反应为可逆反应;
B、求出硫的物质的量,然后根据硫和氢氧化钠溶液的反应为:3S+6NaOH=2Na2S+Na2SO3+3H2O来分析;
C、求出二氧化氮的物质的量,然后根据3mol二氧化氮和水反应转移2mol电子来分析;
D、求出氧化亚铜的物质的量,然后根据氧化亚铜在稀硫酸中发歧化反应来分析.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于NA个,故A错误;
B、32g硫的物质的量为1mol,而硫和氢氧化钠溶液的反应为:3S+6NaOH=2Na2S+Na2SO3+3H2O,在此反应中,3molS转移4mol电子,故1molS转移$\frac{4}{3}$NA个电子,故B错误;
C、标况下6.72L二氧化氮的物质的量为0.3mol,而3mol二氧化氮和水反应转移2mol电子,故0.3mol二氧化氮转移0.2NA个电子,故C错误;
D、28.8g氧化亚铜的物质的量为0.2mol,而氧化亚铜在稀硫酸中发歧化反应:Cu2O+2H+=Cu+Cu2++H2O,此反应中,1mol氧化亚铜转移1mol电子,则0.2mol氧化亚铜转移0.2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
14.自然界中存在的元素大多以化合态存在,而我们在生产生活中需许多单质如金属铁、单质氯等.试想,如果把某元素由化合态变为游离态,则它( )
| A. | 一定被氧化 | B. | 一定得到电子 | ||
| C. | 有可能被氧化,也有可能被还原 | D. | 一定由高价变为零价 |
15.将钠加入到下列溶液中,既产生气体又产生沉淀的是( )
| A. | KCl | B. | CuSO4 | C. | NH4Cl | D. | KNO3 |
8.有机物的命名是有规则的,下列有机物命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. | 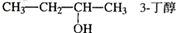 | ||
| C. | 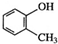 甲基苯酚 甲基苯酚 | D. | 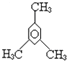 1,3,5-三甲基苯 1,3,5-三甲基苯 |
5.在无色溶液里能大量共存,但加入盐酸后不能大量共存的离子组是( )
| A. | Fe3+、K+、Ag+、NO3-、 | B. | Na+、K+、CO32-、C1- | ||
| C. | NH4+、Al3+、Cl-、NO3- | D. | Mg2+、Na+、CO32-、SO42- |
12.短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体.判断下列说法不正确的是( )
| A. | M元素位于周期表中的第三周期第VIA族 | |
| B. | Z元素是硅,其在自然界中存在游离态 | |
| C. | X与M的单质在高温下反应得到的二元化合物分子中,存在极性共价键 | |
| D. | 四种元素中的Y单质可用于航空航天合金材料的制备 |
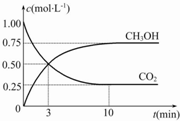 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题: