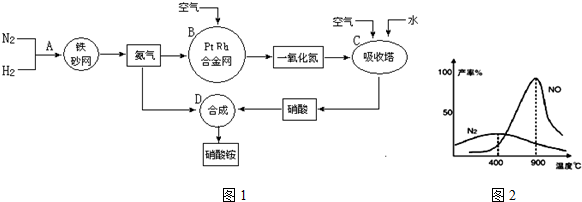
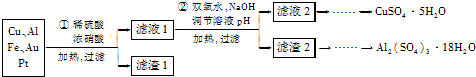
题目内容
15. “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.已知在1100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值增大(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,则在这种情况下,该反应向右进行(填“左”或“右”),判断依据是因为Qc=$\frac{c(C{O}_{2})}{c(CO)}$=0.25<0.263.
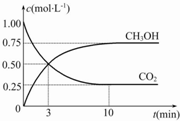
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①该反应的化学平衡常数表达式为K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
②反应达到平衡时,氢气的转化率 α(H2)=75%;
③反应达到平衡后,下列措施能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大的是BD(填序号).
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g)
分析 (1)①△H>0为吸热反应,升高温度,平衡正向移动;
②1100℃时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,计算Qc与K=0.263比较判断平衡移动;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 3 0 0
转化 0.75 0.225 0.75 0.75
平衡 0.25 0.75 0.75 0.75
以此计算转化率;
③措施能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大,应使平衡正向移动,但不能增加CO2的量,以此来解答.
解答 解:(1)①△H>0为吸热反应,升高温度,平衡正向移动,则平衡常数K值增大,故答案为:增大;
②1100℃时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,Qc=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.025mol/L}{0.1mol/L}$=0.25<0.263,则平衡向右移动,
故答案为:右;因为Qc=$\frac{c(C{O}_{2})}{c(CO)}$=0.25<0.263;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比,由反应可知K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,
故答案为:K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 3 0 0
转化 0.75 0.225 0.75 0.75
平衡 0.25 0.75 0.75 0.75
反应达到平衡时,氢气的转化率 α(H2)=$\frac{0.225mol}{3mol}$×100%=75%,
故答案为:75%;
③措施能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大,应使平衡正向移动,但不能增加CO2的量,
A.升高温度,该反应放热,升高温度,平衡向着逆向移动,使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小,故A错误;
B.再充入H2,平衡向着正向移动,使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大,故B正确;
C.再充入CO2,平衡向着正向移动,但是二氧化碳浓度增加的大于甲醇增大浓度,使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小,故C错误;
D.将H2O(g)从体系中分离,平衡向着正向移动,使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大,故D正确;
E.体积不变时充入He(g),各组分浓度不变,平衡不移动,使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$不变,故E错误;
故答案为:BD.
点评 本题考查化学平衡常数及计算,为高频考点,把握平衡常数的意义、化学平衡的计算及平衡移动的影响因素等为解答的关键,侧重分析与应用能力的考查,注意K及转化率的计算,题目难度中等.

| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 铁锈溶于过量醋酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| A. | 燃烧是将化学能只转化为热能 | |
| B. | 浓硫酸溶于水发热,所以该反应为放热反应 | |
| C. | 反应物的总能量高于生成物的总能量是放热反应 | |
| D. | 吸热反应是断裂化学键吸收的总能量小于形成化学键放出的总能量 |
| A. | 4-甲基-2-戊烯 | B. | 2,2-二甲基丙烷 | ||
| C. | 2,3,3-三甲基-2-戊烯 | D. | 4-乙基-2-庚烯 |
| A. | 标况下,22.4L氯气完全溶于水转移电子数为NA | |
| B. | 32gS完全溶于氢氧化钠溶液转移电子数为2 NA | |
| C. | 标况下,6.72LNO2完全溶于水转移电子数为NA | |
| D. | 28.8g氧化亚铜溶于稀硫酸转移电子数为0.2 NA |
| A. | 验证某有机物属于烃,完成的实验只要证明它完全燃烧后的产物只有H2O和CO2 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 黄酒中存在的某些微生物可以使部分乙醇氧化,转化为乙酸,酒就有了酸味 | |
| D. | 乙烯使酸性高锰酸钾溶液,溴的四氯化碳溶液褪色,由于乙烯发生了加成反应 |