题目内容
10.在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,K2Cr2O7是氧化剂;HCl是还原剂;Cl元素被氧化;Cr元素被还原;Cl2是氧化产物;CrCl3是还原产物.分析 K2Cr2O7+14HCl→2KCl+2CrCl3+3Cl2+7H2O反应中Cr元素化合价降低,被还原,生成CrCl3为还原产物,Cl元素化合价升高,被氧化,生成Cl2为氧化产物.
解答 解:K2Cr2O7+14HCl→2KCl+2CrCl3+3Cl2+7H2O反应中Cr元素化合价降低,被还原,则K2Cr2O7具有是氧化性,为氧化剂,生成CrCl3为还原产物,Cl元素的化合价升高,被氧化,则HCl具有还原性,作还原剂,生成的Cl2为氧化产物;
故答案为:K2Cr2O7;HCl;Cl;Cr;Cl2;CrCl3.
点评 本题考查氧化还原反应知识,侧重于学生的分析能力的考查,题目难度不大,注意从元素化合价的角度判断氧化还原反应的相关概念.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
20.下列有关说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 标况下,22.4L氯气完全溶于水转移电子数为NA | |
| B. | 32gS完全溶于氢氧化钠溶液转移电子数为2 NA | |
| C. | 标况下,6.72LNO2完全溶于水转移电子数为NA | |
| D. | 28.8g氧化亚铜溶于稀硫酸转移电子数为0.2 NA |
1.下列说法不正确的是( )
| A. | 发展太阳能发电、利用CO2制造全降解塑料都能有效减少环境污染 | |
| B. | 农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 | |
| C. | 煤的干馏是将煤隔绝空气加强热,得到焦炭、煤焦油、焦炉气等 | |
| D. | 石油产品都可用于聚合反应 |
18.石油的减压分馏可以获得( )
| A. | 石油气 | B. | 汽油 | ||
| C. | 乙烯、丙烯、丁二烯 | D. | 重柴油 |
19.室温下,取浓度都为0.05mol•L-1的NaOH和HCl溶液,以一定的体积比相混合,所得溶液的pH等于12,则两溶液的体积比为( )
| A. | 4:3 | B. | 3:4 | C. | 3:2 | D. | 2:3 |
20.下列生活中常见的变化中,均属于化学变化的一组是( )
| A. | 工业制氧、钢铁生锈 | B. | 石蜡熔化、干冰升华 | ||
| C. | 粮食酿酒、烟花燃放 | D. | 汽油挥发、云消雾散 |
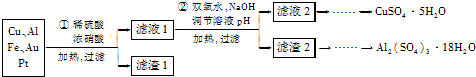
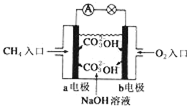 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.