题目内容
14.自然界中存在的元素大多以化合态存在,而我们在生产生活中需许多单质如金属铁、单质氯等.试想,如果把某元素由化合态变为游离态,则它( )| A. | 一定被氧化 | B. | 一定得到电子 | ||
| C. | 有可能被氧化,也有可能被还原 | D. | 一定由高价变为零价 |
分析 某元素在化学反应中由游离态变为化合态,元素的化合价可能升高,也可能降低.
解答 解:A.可能被还原,如Fe+Cu2+=Fe2++Cu,故A错误;
B.可能被氧化,在反应中失去电子,如Cl2+S2-=2Cl-+S,故B错误;
C.某元素在化学反应中由游离态变为化合态,如发生Fe+Cu2+=Fe2++Cu,则被还原,如发生Cl2+S2-=2Cl-+S,则被氧化,故C正确;
D.也可能为低价变为零价,如Cl2+S2-=2Cl-+S,故D错误.
故选C.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重化合价升高或降低的分析,注意利用实例解答,题目难度不大.

练习册系列答案
相关题目
5.HEMA是制备隐形眼镜的材料,其名称是聚甲基丙烯酸羟乙酯,则合成它的单体为( )
| A. | CH3-CH=CH-COOH, | B. |  ,CH3CH2OH ,CH3CH2OH | ||
| C. | 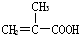 ,HOCH2CH2OH ,HOCH2CH2OH | D. | CH3-CH=CH-COOH,CH3CH2OH |
2.将pH=6的盐酸与pH=4的盐酸等体积混合后,溶液中c(OH-)最接近于( )
| A. | 0.5×(10-8+10-10)mol•L-1 | B. | (10-8+10-10)mol•L-1 | ||
| C. | (1×10-5-5×10-14)mol•L-1 | D. | 2×10-10mol•L-1 |
9.能正确表示下列反应的离子方程式是( )
| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 铁锈溶于过量醋酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
19.在带有活塞的密闭容器中发生反应:Fe2O3+3H2═2Fe+3H2O,采取下列措施不能改变反应速率的是( )
| A. | 将Fe2O3粉碎 | B. | 保持容器体积不变,增加H2输入量 | ||
| C. | 充入N2,保持容器内压强不变 | D. | 充入N2,保持容器内体积不变 |
6.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入硝酸酸化的硝酸钡溶液既无沉淀也无气体生成,再加硝酸银溶液立即出现白色沉淀,一定有Cl- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ |
20.下列有关说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 标况下,22.4L氯气完全溶于水转移电子数为NA | |
| B. | 32gS完全溶于氢氧化钠溶液转移电子数为2 NA | |
| C. | 标况下,6.72LNO2完全溶于水转移电子数为NA | |
| D. | 28.8g氧化亚铜溶于稀硫酸转移电子数为0.2 NA |
