题目内容
8.把500mL有BaCl2和KCl的混合溶液分成2等份,一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )| A. | 0.1(b-2a)mol/L | B. | 0.4( 2a-b)mol/L | C. | 10(b-2a)mol/L | D. | 4(b-2a)mol/L |
分析 混合溶液分成两等份,每份溶液浓度相同,一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4);
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),
再利用电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液的浓度相同,一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4)=amol;
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+)=bmol,
根据电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),每份溶液中n(K+)=bmol-2amol=(b-2a)mol,
溶液具有均一性,则原溶液中钾离子浓度为:c(K+)=$\frac{(b-2a)mol}{0.25L}$=4(b-2a) mol•L-1,
故选D.
点评 本题考查物质的量浓度的计算,题目难度中等,根据电荷守恒计算钾离子的物质的量是关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列指定反应的离子方程式正确的是( )
| A. | 将铜丝插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 稀H2SO4与Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
20.下列变化属于吸热的化学反应的是( )
| A. | 碘的升华 | B. | 生石灰溶于水 | ||
| C. | 酸碱中和 | D. | Ba(OH)2•8H2O与NH4Cl晶体混合 |
17.下列反应中,水作氧化剂的是( )
| A. | C+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2 | B. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | Cl2+H2O?HCl+HClO | D. | SO3+H2O=H2SO4 |
16.一种电池的正极材料的化学式可表示为Li2Fe1-xMnxSiO4,其中锂显+1价,0<x<1,铁、锰的化合价依次为( )
| A. | +2,+2 | B. | +2,+3 | C. | +2,+4 | D. | +3,+3 |
 CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)

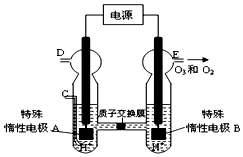 过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题:
过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题: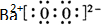 (写电子式),
(写电子式),