题目内容
5.下列说法正确的是( )| A. | 烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网 | |
| B. | 分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水 | |
| C. | 配制1 mol•L-1NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒 | |
| D. | 量取25.00ml某盐酸,可以用量筒或者酸式滴定管 |
分析 A.蒸发皿可直接加热;
B.具有塞子或活塞的仪器需要查漏;
C.焰色反应实验需要铂丝;
D.量筒的感量为0.1mL.
解答 解:A.蒸发皿可直接加热,则烧瓶、锥形瓶加热时均需要垫上石棉网,故A错误;
B.具有塞子或活塞的仪器需要查漏,则分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水,故B正确;
C.焰色反应实验需要铂丝,而配制1 mol•L-1NaCl溶液、测定Na2CO3溶液的pH均需要用到玻璃棒,故C错误;
D.量筒的感量为0.1mL,量取25.00ml某盐酸,可选酸式滴定管,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、焰色反应、pH测定、实验技能为解本题关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
7.图为实验室制取少量乙酸乙酯的装置图.下列叙述不正确的是( )
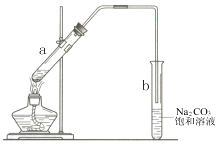

| A. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
16.下列反应是氧化还原反应的是( )
| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | NaCl+AgNO3=AgCl↓+NaNO3 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | CaO+H2O=Ca(OH)2 |
13.下列溶液可用无色试剂瓶装的是( )
| A. | 浓HNO3 | B. | AgNO3 | C. | 氯水 | D. | 浓H2SO4 |
20.恒温恒容条件下,能使A(g)+B(g)?C(g)+D(s) 正反应速率加快的是( )
| A. | 减少C或D的物质的量 | B. | 体积不变充入氦气 | ||
| C. | 减少B的物质的量 | D. | 增大A或B的物质的量 |
10.下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O?H3O++Cl-
②Na2CO3+H2O?H2CO3+2NaOH
③Na2CO3+2H2O?H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+.
①HCl+H2O?H3O++Cl-
②Na2CO3+H2O?H2CO3+2NaOH
③Na2CO3+2H2O?H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+.
| A. | ①②③④ | B. | ①②③ | C. | ②③⑤ | D. | 全部 |
17.下列说法正确的是( )
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 除去KNO3中混杂的NaCl,可用重结晶的方法,是因为氯化钠在水中溶解度大 | |
| C. | 用量筒量取20mL 0.5 mol•L-1H2SO4于烧杯中,加水80mL,配制成0.1 mol•L-1H2SO4溶液 | |
| D. | 将足量的Na2O、Na2O2分别加入到酚酞溶液中,最终溶液均为红色 |
14.下列说法错误的是( )
| A. | PH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液c(Na + ):①>②>③ | |
| B. | 加热0.1mol/LNa2CO3溶液,CO3 2- 的水解程度和溶液的PH均增大 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红,原因是:CO3 2-+H2O?HCO3-+OH- |
20.不能说明反应P(g)+Q(g)?R(g)+S(s)在恒温、恒容下已达到平衡的是( )
| A. | 反应容器内的压强不随时间改变 | |
| B. | 反应容器内P、Q、R、S四者共存 | |
| C. | P的生成速率和S的生成速率相等 | |
| D. | 反应容器内的气体总物质的量不随时间变化 |