题目内容
11.下列有关氧化还原反应的叙述正确的是( )| A. | 氧化剂被还原,还原剂被氧化 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 失电子难的物质,获得电子的能力一定强 | |
| D. | 一种元素被氧化,肯定有另一种元素被还原 |
分析 A.得电子的物质为氧化剂,失电子的物质为还原剂;
B.同素异形体的转化不属于氧化还原反应;
C.稀有气体既不易失电子也不易得电子;
D.氧化还原反应中可能只有一种元素的化合价发生变化.
解答 解:A.得电子的物质为氧化剂,氧化剂被还原,失电子的物质为还原剂,还原剂被氧化,故A正确;
B.有单质参加或有单质生成的反应不一定是氧化还原反应,如:石墨转化为金刚石就不是氧化还原反应,故B错误;
C.稀有气体既不易失电子也不易得电子,所以失去电子难的原子不一定容易获得电子,故C错误;
D.氧化还原反应中可能只有一种元素的化合价发生变化,如氯气与水反应中Cl元素既被氧化又被还原,故D错误;
故选A..
点评 本题考查氧化还原反应,明确反应中元素的化合价及基本概念即可解答,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
1.化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )


| A. | 化合物与氧化物属于交叉关系 | B. | 单质与非电解质属于包含关系 | ||
| C. | 溶液与分散系属于并列关系 | D. | 化合物与电解质属于包含关系 |
2.下列溶液中Cl-物质的量浓度与25mL1mol/L AlCl3溶液的Cl-物质的量浓度相等的是( )
| A. | 100mL2.5mol/L NaCl溶液 | B. | 200mL2mol/L MgCl2溶液 | ||
| C. | 300mL3mol/L KCl溶液 | D. | 150mL2mol/L AlCl3溶液 |
19.下列有关有机化合物的说法正确的是( )
| A. | 乙烷室温下能与浓盐酸发生取代反应 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | C4H9Cl有3种同分异构体 | |
| D. | 油脂和蛋白质都属于高分子化合物 |
1.常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
| A. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| B. | 两清液混合,AgCl和AgI都沉淀 | |
| C. | 若取0.1435 g AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01 mol/L | |
| D. | 向AgI清液加入AgNO3,c(Ag+)增大,Ksp(AgI)也增大 |
8.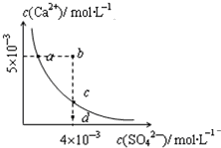 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )| A. | CaSO4溶解在水中,c(Ca2+)=c(SO42-)=3×10-3mol/L | |
| B. | 在d点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3mol/L |
6. 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
(1)已知:①2CH4(g)+3O2(g)?2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+H2O(g)?CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是CD.
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
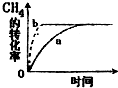
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是增加了催化剂.
(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H得到如表三组数据:
①实验1中以v(H2)表示的反应速率为0.16mol•(L•min-1).
②实验2中的平衡常数是0.17(计算结果保留两位小数).
③该反应的△H<0(填“>”或“<”).
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a或a:b=1:2(用含a、b的式子表示).
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.(1)已知:①2CH4(g)+3O2(g)?2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+H2O(g)?CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是CD.
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是增加了催化剂.
(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | D | t |
②实验2中的平衡常数是0.17(计算结果保留两位小数).
③该反应的△H<0(填“>”或“<”).
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a或a:b=1:2(用含a、b的式子表示).
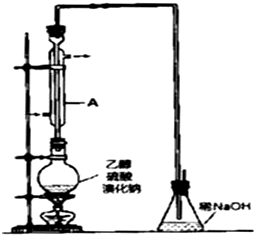 有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O.
有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O.