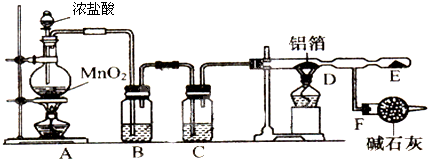
题目内容
6. 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.(1)已知:①2CH4(g)+3O2(g)?2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol.
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+H2O(g)?CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是CD.
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
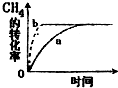
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是增加了催化剂.
(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g);△H得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | D | t |
②实验2中的平衡常数是0.17(计算结果保留两位小数).
③该反应的△H<0(填“>”或“<”).
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系是b=2a或a:b=1:2(用含a、b的式子表示).
分析 (1)①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=-1214.6kJ/mol;
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
根据盖斯定律,$\frac{①+②}{2}$计算得到;
(2)①根据化学平衡状态的特征:正逆反应速率相等、各组分的浓度不随时间的变化而变化以及密度和平均相对分子质量的公式进行判断;
②根据影响化学反应速率以及平衡移动的因素来分析;
(3)①由表中数据可知,H2的物质的量变化量为1.6mol,根据v=$\frac{△c}{△t}$计算v(H2);
②根据K=$\frac{c(CO{\;}_{2})•c(H{\;}_{2})}{c(CO)•c(H{\;}_{2}O)}$结合三行式计算K;
③根据温度和K的变化关系确定反应的吸放热;
④根据等效平衡原理来确定.
解答 解:(1)已知①2CH4(g)+3O2(g)═2CO(g)+4H2O(l);△H1=-1214.6kJ/mol;
②2CO(g)+O2(g)?2CO2(g)△H2=-566kJ/mol,
根据盖斯定律,$\frac{①+②}{2}$得CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol;
(2)A.3v(CH4)正=v(H2)逆才能说明正逆反应速率相等,故A错误;
B.水蒸气的浓度与一氧化碳的浓度相等,不能说明达到了平衡,故B错误;
C.平均相对分子质量等于质量和物质的量的比值,质量守恒,但是物质的量是变化的,当平均相对分子质量不随时间的变化而变化,达到了平衡,故C正确;
D.根据ρ=$\frac{m}{V}$,质量守恒,恒温恒压下体积变化,所以密度变化,当密度不随时间的变化而变化,证明达到了平衡,故D正确;
故答案为:CD;
②CH4转化率随时间变化b曲线与实验a相比,反应速率加快了,但是平衡没变,所以是增加了催化剂的原因,故答案为:增加了催化剂;
(3)①由表中数据可知,H2的物质的量变化量为0.4mol,v=$\frac{△c}{△t}$得到v(H2)=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol•(L•min-1),故答案为:0.16mol•(L•min-1);
②CO(g)+H2O(g)?CO2(g)+H2(g)
初始量:1 2 0 0
变化量:0.4 0.4 0.4 0.4
平衡量:0.6 1.6 0.4 0.4
根据K=$\frac{c(CO{\;}_{2})•c(H{\;}_{2})}{c(CO)•c(H{\;}_{2}O)}$=$\frac{0.4×0.4}{0.6×1.6}$=0.17,
故答案为:0.17;
③实验1中 CO(g)+H2O(g)?CO2(g)+H2(g);
初始量:2 4 0 0
变化量:1.6 1.6 1.6 1.6
平衡量:0.4 2.4 1.6 1.6
根据K=$\frac{c(CO{\;}_{2})•c(H{\;}_{2})}{c(CO)•c(H{\;}_{2}O)}$=$\frac{1.6×1.6}{0.4×2.4}$=2.67>0.17,所以温度升高,K减小,逆向移动,则正反应放热,即△H<0,
故答案为:<;
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),只要投料等比即等效,所以a:b=1:2或b=2a,
故答案为:b=2a或a:b=1:2.
点评 本题考查反应速率、平衡常数、化学平衡有关计算应用,难度中等,注意对知识的理解与掌握,是对学生能力的考查.

| A. | 氧化剂被还原,还原剂被氧化 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 失电子难的物质,获得电子的能力一定强 | |
| D. | 一种元素被氧化,肯定有另一种元素被还原 |

 (3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.