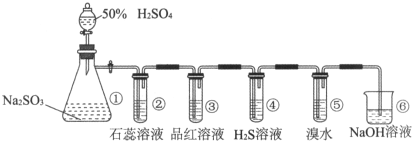
题目内容
2.在通风橱中进行的下列实验:| 步骤 | 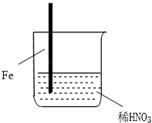 | 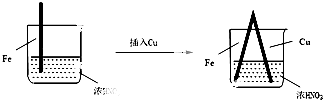 | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |
分析 A.硝酸具有强氧化性,与Fe反应生成NO,NO遇空气变为二氧化氮;
B.浓硝酸具有强氧化性,Fe表面形成致密的氧化层,发生钝化现象;
C.对比I、Ⅱ的现象,Fe与稀硝酸反应生成NO,而Fe与浓硝酸反应生成二氧化氮且迅速被钝化,说明浓硝酸的氧化性强于稀硝酸;
D.根据Ⅲ中现象,说明构成原电池,在Fe、Cu之间连接电流计,通过电流计指针偏转,可以判断原电池的正负极.
解答 解:A.稀硝酸具有酸性与强氧化性,与Fe反应生成NO,NO遇空气变为二氧化氮,Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2,故A正确;
B.Ⅱ的现象是因为铁发生了钝化,Fe表面形成致密的氧化层,阻止Fe进一步反应,故B正确;
C.对比I、Ⅱ的现象,Fe与稀硝酸反应生成NO,而Fe与浓硝酸反应生成二氧化氮且迅速被钝化,说明浓硝酸的氧化性强于稀硝酸,故C错误;
D.根据Ⅲ中现象,说明构成原电池,在Fe、Cu之间连接电流计,通过电流计指针偏转,可以判断原电池的正负极,进而判断Fe是否被氧化,故D正确,
故选:C.
点评 本题考查硝酸的化学性质、原电池原理,难度不大,侧重考查学生分析解决问题的能力.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
12.将氯化铝溶液加热蒸干、灼烧,最后所得固体的主要成分是( )
| A. | 水合三氯化铝 | B. | 氢氧化铝 | C. | 无水氯化铝 | D. | 氧化铝 |
13.下列说法不正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH-)>c(A-) | |
| B. | 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 | |
| C. | 稀氨水中部分粒子的浓度大小关系:c(NH3•H2O)>c(OH-)>c(NH4+)>c(H+) | |
| D. | 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
10.短周期元素A、B、C、D、E,原子序数依次增大.已知元素A的气态氢化物和A的最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子数是次外层的3倍;D是地壳中含量最多的金属元素;C是短周期中与水反应最激烈的金属元素.下列叙述不正确的是( )
| A. | 元素A的氢化物比元素B的氢化物更稳定 | |
| B. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 | |
| C. | 原子半径:C>D>B | |
| D. | 元素B的气态氢化物的沸点比元素E气态氢化物的沸点高 |
7.在A(g)+B(g)?C(g)+D(g)反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1.0 mol/(L•s) |
11.下列说法正确的是( ) ( NA表示阿伏加德罗常数值 )
①11.2L氨气所含有的分子数一定是0.5NA
②在常压、室温条件下,1mol氩气含有的原子数为NA
③48g 臭氧所含有的原子数为3NA
④在同温同压时,相同体积的任何气体单质所含有的原子数目相同.
①11.2L氨气所含有的分子数一定是0.5NA
②在常压、室温条件下,1mol氩气含有的原子数为NA
③48g 臭氧所含有的原子数为3NA
④在同温同压时,相同体积的任何气体单质所含有的原子数目相同.
| A. | ①、② | B. | ②、③ | C. | ①、②、③ | D. | ②、③、④ |
12.关于醋酸钠溶液,下列说法正确的是( )
| A. | 向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大 | |
| B. | 离子浓度大小比较:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 向其中加入盐酸至恰好呈中性时,c(Na+)=c(CH3COO-) | |
| D. | 加水稀释时$\frac{c(C{H}_{3}C{O}^{-})}{c(N{a}^{+})}$的值减小 |