题目内容
16.Al、Fe、Cu都是重要的金属元素,下列说法正确的是( )| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 常温下三者加入浓硫酸中均无明显现 | |
| D. | Fe2O3与Fe3O4互为同素异形体 |
分析 A.氧化铝可与酸、碱都反应;
B.铜腐蚀可生成碱式碳酸铜;
C.铝、铁常温下在浓硫酸中发生钝化,反应生成致密氧化物薄膜阻止反应进行,而铜的活泼性弱;
D.同素异形体为同种元素形成的不同种单质.
解答 解:A.氧化铝可与酸、碱都反应,为两性氧化物,不是碱性氧化物,故A错误;
B.铜在空气中可生成碱式碳酸铜,不是氧化物,故B错误;
C.铝、铁常温下在浓硫酸中发生钝化,反应生成致密氧化物薄膜阻止反应进行,是浓硫酸的强氧化性,而铜的活泼性弱,常温下与浓硫酸不反应,故C正确;
D.同素异形体为同种元素形成的不同种单质,Fe2O3与Fe3O4都是化合物,故D错误.
故选C.
点评 本题考查元素化合物知识,侧重于学生的分析能力和元素化合物知识的综合理解和应用的考查,为高频考点,注意相关基础知识的积累和学习,难度不大.

练习册系列答案
相关题目
6.玻尔认为原子核外电子离核越近能量越低.那么,电子从离核无穷远处跃迁到氢离子(H+)的K层所释放的光子在氢原子的发射光谱中对应( )的光子.
| A. | 波长最长 | B. | 波长最短 | C. | 平均波长 | D. | 中间波长 |
7.下列物质中,不能作为食品添加剂的是( )
| A. | 白醋 | B. | 白酒 | C. | 甲醇 | D. | 小苏打 |
4.热化学方程式中要注明物质状态的原因是( )
| A. | 便于判断性质 | B. | 物质呈现的状态跟它所含能量有关 | ||
| C. | 便于计算 | D. | 为了区别一般的化学方程式 |
1.福建漳州古雷腾龙 PX 化工厂爆炸,再次引发了人们对 PX 的关注,查阅资料知 PX 是对二甲苯(英文名称 p-xylene,缩写为 PX),它是化学工业的重要原料. 下面有关 PX 的说法不正确的是( )
| A. | PX 的结构简式为: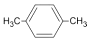 | |
| B. | PX 的同分异构体有 2 种(不包含自身) | |
| C. | PX 能发生取代反应和加成反应 | |
| D. | PX 不能使溴的四氯化碳溶液褪色 |
8.下列关于有机化合物的说法正确的是( )
| A. | 2-甲基丁烷也称异丁烷 | |
| B. |  的-溴代物和 的-溴代物和 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| C. | 烷烃 的命名是:3-异丙基己烷 的命名是:3-异丙基己烷 | |
| D. |  与 与  互为同系物 互为同系物 |
5.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,溶液中的OH-由负极向正极移动 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
19.下列固体物质溶液水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )
①胆矾 ②氯化铝 ③硫酸铝 ④纯碱 ⑤氯化铜.
①胆矾 ②氯化铝 ③硫酸铝 ④纯碱 ⑤氯化铜.
| A. | ③④ | B. | ①③④ | C. | ①②③④ | D. | 全部 |