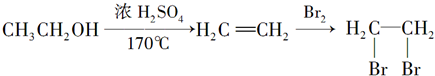题目内容
已知M、R、T、X、Y、Z六种元素的原子序数依次递增的前四周期元素,M位于周期表的s区,其原子中电子层数和未成对电子数相同;R的基态原子中电子占据四个原子轨道(空间运动状态);T的基态原子的核外未成对电子数是同周期元素中最多的.Y是电负性最大的元素,Z是最外层电子数最少的元素中电子运动状态最多的元素.
请回答下列问题:(答题时,M、R、T、X、Y、Z用所对应的元素符号表示)
(1)T的核外电子排布图为 ,Z的一价阳离子的价层电子排布式 .
(2)M和R形成的原子个数比为2:1的气态化合物为石油化工的基本原料,该物质中R原子的杂化方式为 该化合物中σ键和π键的个数比为 .
(3)T、X、Y与M形成的简单化合物的沸点由高到低的顺序为 (用化学式表示).
(4)XY2的空间立体构型为 ,M2X与XY2的分子的极性强弱的关系为 > (用化学式表示).
电负性F:4.0 O:3.5 H:2.1 S:2.5 Be:1.5
从原子的电负性,中心原子的孤对电子等角度解释极性强弱的原因是 .
(5)查阅有关金属晶体资料得到
Z的原子半径为a pm,NA代表阿伏加德罗常数,则Z的晶体堆积模型为 ,该金属单质的密度为 g/cm3(计算结果保留两位有效数字).
请回答下列问题:(答题时,M、R、T、X、Y、Z用所对应的元素符号表示)
(1)T的核外电子排布图为
(2)M和R形成的原子个数比为2:1的气态化合物为石油化工的基本原料,该物质中R原子的杂化方式为
(3)T、X、Y与M形成的简单化合物的沸点由高到低的顺序为
(4)XY2的空间立体构型为
电负性F:4.0 O:3.5 H:2.1 S:2.5 Be:1.5
从原子的电负性,中心原子的孤对电子等角度解释极性强弱的原因是
(5)查阅有关金属晶体资料得到
| 堆积模型 | 空间利用率 | 配位数 |
| bcp | 68% | 8 |
| hcp | 74% | 12 |
| ccp(fcc) | 74% | 12 |
考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:Y是电负性最大的元素,应为F,T的基态原子的核外未成对电子数是同周期元素中最多的,且核电荷数小于F,应为N元素,M位于周期表的s区,其原子中电子层数和未成对电子数相同,应为H元素,R的基态原子中电子占据四个原子轨道(空间运动状态),核外电子排布为1s22s22p2,应为C元素,则由核电荷数关系可知X只能为O,Z是最外层电子数最少的元素中电子运动状态最多的元素,在前四周期中只有Cu符合,结合对应单质、化合物的性质以及题目要求解答该题.
解答:
解:Y是电负性最大的元素,应为F,T的基态原子的核外未成对电子数是同周期元素中最多的,且核电荷数小于F,应为N元素,M位于周期表的s区,其原子中电子层数和未成对电子数相同,应为H元素,R的基态原子中电子占据四个原子轨道(空间运动状态),核外电子排布为1s22s22p2,应为C元素,则由核电荷数关系可知X只能为O,Z是最外层电子数最少的元素中电子运动状态最多的元素,在前四周期中只有Cu符合,
(1)T为N元素,原子核外有2个电子层,核外电子排布图为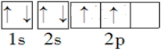 ,Z为Cu一价阳离子的价层电子排布式为1s22s22p63s23p63d10,
,Z为Cu一价阳离子的价层电子排布式为1s22s22p63s23p63d10,
故答案为: ;1s22s22p63s23p63d10;
;1s22s22p63s23p63d10;
(2)H和C形成的原子个数比为2:1的气态化合物为石油化工的基本原料为C2H4,C2H4分子中C原子有3个σ键,无孤电子对,轨道的杂化类型为sp2杂化,1个C2H4分子中含有5个σ键,1个π键,σ键和π键的个数比为5:1,
故答案为:sp2杂化;5:1;
(3)N、O、F与M形成的简单化合物分别为NH3、H2O、HF,应非金属性F>O>N,HF中含有的氢键作用力大于水和氨气,但水中含有的氢键数目最多,沸点高低顺序为H2O>HF>NH3,
故答案为:H2O>HF>NH3;
(4)XY2为OF2,O形成2个δ键,孤对电子数为
=2,具有水的空间构型,为V形,H2O与OF2的分子,氧与氢的电负性差值=3.5-2.1=1.4,氧与氟的电负性差值=3.5-4.0=-0.5,所以氧与氢的电负性差值>氧与氟的电负性差,形成共价键的两种元素的电负性之差越大,则极性越强,所以极性H2O>OF2,且OF2中氧原子上有2对孤对电子,抵消了O-F键中共用电子对偏向F而产生的极性,
故答案为:V形;H2O;HF;氧与氢的电负性差值>氧与氟的电负性差,OF2中氧原子上有2对孤对电子,抵消了O-F键中共用电子对偏向F而产生的极性;
(5)铜晶胞中铜原子位于顶点和面心,即晶胞类型为面心立方堆积,铜原子半径为a pm,即a×10-10cm,则则晶胞边长=2
a×10-10cm,晶胞体积V=(2
a×10-10cm)3,每个晶胞中铜原子个数=8×
+6×
=4,
则ρ=
=
=
=
×1030g/cm3;
故答案为:面心立方堆积;
×1030g/cm3.
(1)T为N元素,原子核外有2个电子层,核外电子排布图为
 ,Z为Cu一价阳离子的价层电子排布式为1s22s22p63s23p63d10,
,Z为Cu一价阳离子的价层电子排布式为1s22s22p63s23p63d10,故答案为:
 ;1s22s22p63s23p63d10;
;1s22s22p63s23p63d10;(2)H和C形成的原子个数比为2:1的气态化合物为石油化工的基本原料为C2H4,C2H4分子中C原子有3个σ键,无孤电子对,轨道的杂化类型为sp2杂化,1个C2H4分子中含有5个σ键,1个π键,σ键和π键的个数比为5:1,
故答案为:sp2杂化;5:1;
(3)N、O、F与M形成的简单化合物分别为NH3、H2O、HF,应非金属性F>O>N,HF中含有的氢键作用力大于水和氨气,但水中含有的氢键数目最多,沸点高低顺序为H2O>HF>NH3,
故答案为:H2O>HF>NH3;
(4)XY2为OF2,O形成2个δ键,孤对电子数为
| 6-2 |
| 2 |
故答案为:V形;H2O;HF;氧与氢的电负性差值>氧与氟的电负性差,OF2中氧原子上有2对孤对电子,抵消了O-F键中共用电子对偏向F而产生的极性;
(5)铜晶胞中铜原子位于顶点和面心,即晶胞类型为面心立方堆积,铜原子半径为a pm,即a×10-10cm,则则晶胞边长=2
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
则ρ=
| m |
| V |
| ||
| V |
| ||
(2
|
8
| ||
| a3?NA |
故答案为:面心立方堆积;
8
| ||
| a3?NA |
点评:本题考查了物质结构及其性质,涉及原子杂化方式的判断、价电子排布式的书写、元素周期律、晶胞的计算等知识点,题目综合性较强,注意根据价层电子对互斥理论、构造原理等知识来分析解答,题目难度大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
用NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A、将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 |
| B、1mol氧元素组成的单质一定含有2NA氧原子 |
| C、在H2O2+Cl2=2HCl+O2反应中,毎生成32g氧气,则转移2NA个电子 |
| D、含NA个Na+的 Na2O溶解于1L水中,Na+的物质的量浓度为1mol?L-1 |
迷迭香酸是从蜂花属植物中提取得到的酸性物质如图.下列取叙述正确的是( )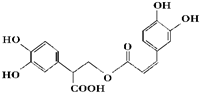

| A、迷迭香酸属于芳香烃 |
| B、1mol迷迭香酸最多能和含6mol NaOH的水溶液完全 |
| C、迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D、1mol迷迭香酸最多能和9mol氢气发生加成反应 |
下列除杂(括号内是杂质),所用方法合理的是( )
| A、碳酸氢钠固体(碳酸钠):加热固体混合物使之分解 |
| B、铁粉(铝):加入足量稀盐酸,充分反应后过滤、洗涤、干燥 |
| C、硫酸亚铁溶液(硫酸铁):加入足量铁屑,充分反应后过滤 |
| D、二氧化碳(氯化氢):依次通过盛有氢氧化钠溶液、浓硫酸的洗气瓶 |

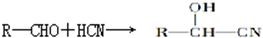 ,②R-CN
,②R-CN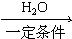 R-COOH
R-COOH 制备高分子化合物
制备高分子化合物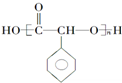 的合成路线流程图
的合成路线流程图