题目内容
3.按要求回答下列问题:(1)当NH3和N2H4中分子个数比为1:1 时,原子总数之比为2:3,电子数之比为5:9.
(2)某Al2(SO4)3溶液V mL中含有Al3+a g,取出$\frac{V}{4}$ mL溶液稀释成V mL后,SO42-的物质的量浓度为$\frac{125a}{9V}$(用含a、V的代数式表示,化简到最简整数比).
(3)以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④铝 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融KNO3,其中属于电解质的是①③⑤⑧(填编号,下同),能导电的是④⑧.
(4)实验室盛装NaOH溶液的试剂瓶不能用玻璃塞,应该用橡胶塞,以防止发生反应:
SiO2+2OH-=SiO32-+H2O(离子方程式).
(5)用一种试剂除去下列物质中的杂质(括号内为杂质),并写出离子方程式
①CO2(HCl):试剂饱和碳酸氢钠溶液,离子方程式HCO3-+H+═H2O+CO2↑.
②NaHCO3(Na2SiO3):试剂足量二氧化碳,离子方程式SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-.
③FeCl2(FeCl3):试剂足量铁粉,离子方程式2Fe3++Fe=3Fe2+.
分析 (1)1个NH3含有4个原子,10个电子;1个N2H4含有6个原子,18个电子;
(2)计算出ag铝离子的物质的量,然后根据化学式Al2(SO4)3计算出硫酸根离子的物质的量,从而得出$\frac{V}{4}$mL溶液中含有硫酸根离子得到物质的量,再根据吸收过程中溶质的物质的量不变计算出稀释后溶液中硫酸根离子的浓度;
(3)在水溶液或者熔融状态下能够导电的化合物属于电解质,在水溶液和熔融状态下都不导电的化合物属于非电解质;
物质导电的条件含有自由移动的电子,或者自由移动的离子;
(4)玻璃中的二氧化硅为酸性氧化物,能够与氢氧化钠反应生成具有粘性的硅酸钠水溶液;
(5)①HCl与饱和碳酸氢钠反应生成二氧化碳;
②硅酸钠与足量的二氧化碳反应生成碳酸氢钠和硅酸沉淀;
③铁与氯化铁反应生成氯化亚铁;
解答 解:(1)当NH3和N2H4中分子个数比为1:1 时,原子总数之比为:1×4:1×6=2:3;电子数为:1×10:1×18=5:9;
故答案为:2:3;5:9;
(2)ag铝离子的物质的量为:n(Al3+)=$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol;VmL该溶液中含有硫酸根离子的物质的量为:$\frac{a}{27}$mol×$\frac{3}{2}$=$\frac{a}{18}$mol,则$\frac{V}{4}$mL溶液中含有硫酸根离子得到物质的量为:$\frac{a}{18}$mol×$\frac{1}{4}$=$\frac{a}{72}$mol,溶质在稀释过程中溶质的物质的量不变,所以稀释后溶液中硫酸根离子的物质的量浓度为:c(SO42-)=$\frac{n}{V}$=$\frac{\frac{a}{72}}{V×10{\;}^{-3}}$=$\frac{125a}{9V}$mol/L;
故答案为:$\frac{125a}{9V}$;
(3)①NaCl晶体是化合物,在水溶液或者熔融状态下能够导电是电解质;不含自由自由移动的电子,也不含自由移动的离子,不导电;
②液态SO3 是化合物,本身不能电离产生自由移动的离子而导电,属于非电解质;不含自由自由移动的电子,也不含自由移动的离子,不导电;
③液态的醋酸是化合物,在水溶液能够导电是电解质;不含自由自由移动的电子,也不含自由移动的离子,不导电;
④铝 是单质,既不是电解质,也不是非电解质;含有自由电子,能导电;
⑤BaSO4固体 是化合物,熔融状态下能够导电是电解质;不含自由自由移动的电子,也不含自由移动的离子,不导电;
⑥蔗糖(C12H22O11)是化合物,在水溶液和熔融状态下都不导电的化合物属于非电解质;不含自由自由移动的电子,也不含自由移动的离子,不导电;
⑦酒精(C2H5OH)是化合物,在水溶液和熔融状态下都不导电的化合物属于非电解质;不含自由自由移动的电子,也不含自由移动的离子,不导电;
⑧熔融KNO3,是化合物,水溶液或者熔融状态下能导电,是电解质;含有自由移动的离子,能够导电;
所以属于电解质的是①③⑤⑧,能导电的是④⑧;
故答案为:①③⑤⑧;④⑧;
(4)玻璃中的二氧化硅为酸性氧化物,能够与氢氧化钠反应生成具有粘性的硅酸钠水溶液,离子方程式:SiO2+2OH-=SiO32-+H2O;
故答案为:SiO2+2OH-=SiO32-+H2O;
(5)①除去CO2中的HCl气体,选择试剂为饱和碳酸氢钠溶液,发生离子方程式为HCO3-+H+═H2O+CO2↑,
故答案为:饱和碳酸氢钠溶液;HCO3-+H+═H2O+CO2↑;
②除去碳酸氢钠中的少量硅酸钠可以通入足量的二氧化碳,二者反应生成碳酸氢钠和硅酸沉淀,离子方程式:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-;
故答案为:足量二氧化碳;SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-;
③除去氯化亚铁中少量的氯化铁,可以加入足量铁粉,二者反应离子方程式:2Fe3++Fe=3Fe2+;
故答案为:足量铁粉;2Fe3++Fe=3Fe2+.
点评 本题为综合题,考查了物质的量有关计算、电解质判断、离子反应的书写及物质的除杂,明确常见的分离提纯方法及物质的性质为解答的关键,注意利用性质的差异选择试剂,注重基础知识的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 钾元素 | B. | 钡元素 | C. | 铜元素 | D. | 钠元素 |
| A. | 用洁净的铂丝蘸取某溶液在酒精灯火焰上灼烧,若通过蓝色的钴玻璃观察火焰呈紫色,则原溶液中一定有K+离子,一定没有Na+离子 | |
| B. | 向某溶液中加入AgNO3溶液有白色沉淀产生,再加稀HNO3,沉淀不消失,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入BaCl2溶液有白色沉淀,再加稀HNO3,沉淀不消失,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入稀盐酸若产生能使用澄清石灰水变浑浊的气体,则原溶液中一定有CO32- |
| A. | 任何能使熵值增大的过程都自发进行 | |
| B. | 已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ•mol-1(Q>0),则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 | |
| C. | 人类利用的能源都是通过化学反应获得的 | |
| D. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
| 编号 | 实验内容 | 实验目的 |
| A | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| B | 室温下,用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液和0.1 mol•L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | B、C、D离子的半径大小是D>B>C | |
| B. | C的单质能将F单质从AF的溶液中置换出来 | |
| C. | 氧化物对应的水化物的酸性:B<F | |
| D. | B与C能存在F同一离子化合物中 |
| A. | X的气态简单氢化物的热稳定性比W的强 | |
| B. | 由Y、Z两种元素组成的化合物是离子化合物 | |
| C. | W的氧化物可与Z的最高氧化物对应水化物反应 | |
| D. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) |
| A. | SO2、O2、SO3的浓度相等 | B. | SO2、O2、SO3的浓度不再发生变化 | ||
| C. | SO2、O2、SO3在密闭容器中共存 | D. | 反应停止,正、逆反应速率都等于零 |
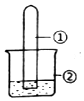 用图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | NH3 | AlCl3溶液 | 产生白色沉淀 |
| D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |