题目内容
18.下列实验事实能达到目的是( )| 编号 | 实验内容 | 实验目的 |
| A | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| B | 室温下,用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液和0.1 mol•L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,可知亚硫酸的酸性大于碳酸的酸性;
B.NaClO溶液具有漂白性;
C.含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅,可知水解平衡逆向移动;
D.NaOH溶液过量,为沉淀的生成.
解答 解:A.测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,可知亚硫酸的酸性大于碳酸的酸性,亚硫酸不是最高价含氧酸,不能比较非金属性,故A错误;
B.NaClO溶液具有漂白性,不能利用pH试纸测定其pH,则不能比较酸性,故B错误;
C.含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅,可知水解平衡逆向移动,该实验可证明Na2CO3溶液中存在水解平衡,故C正确;
D.NaOH溶液过量,为沉淀的生成,不发生沉淀的转化,则不能比较Ksp,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高考常见题型和高频考点,把握盐类水解、沉淀的生成及转化、酸性比较为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.我国古代文献资料中记载了大量的化学研究过程与成果.下列选项不涉及化学变化的是( )
| 选项 | A | B | C | D |
| 原文 | 欲去杂还纯,再入水煎炼,倾入盆中,经宿成白雪 | 以曾青凃铁,铁赤色如铜 | 丹砂烧之成水银,积变又还成丹砂 | 水火既济而土和 |
| 解释 | 重结晶方法提纯物质 | 金属的置换 | 物质间转化的可逆性 | 黏土烧结成陶瓷 |
| A. | A | B. | B | C. | C | D. | D |
9.下列分子或离子中的电子为奇数的是( )
| A. | F2O | B. | CO2 | C. | ClO2 | D. | CN- |
6.下列叙述正确的是( )
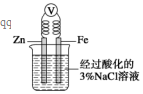

| A. | 将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 | |
| B. | 将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色 | |
| C. | 如图,一段时间后给烧杯内的溶液中加入氢氧化钠溶液,可看到Fe电极附近有红褐色沉淀生成 | |
| D. | 向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 |
13.在绝热密闭容器中发生反应:aM(g)+bN(g)?cW(g) 达平衡后,测得M气体的浓度为0.5mol/L.若将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L.则下列叙述正确的是( )
| A. | 反应速率增大 | B. | 平衡向右移动 | C. | 体系温度升高 | D. | W的质量分数降低 |
10.由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示.下列说法正确的是( )
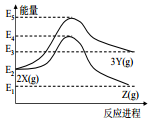

| A. | 由 X→Z 反应的△H<0 | B. | 由 X→Y 反应的△H=E5-E2 | ||
| C. | 增大压强有利于提高 Y 的产率 | D. | 升高温度有利于提高 Z 的产率 |
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8g O2含有4NA个电子 | |
| B. | 1L 0.1mol•L-1的氨水中有0.1NA个NH4+ | |
| C. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| D. | 1 mol苯乙烯中含碳碳双键数为4NA |
8.下列物质分别在氯气中燃烧,能产生白烟现象的是( )
| A. | Na | B. | H2 | C. | Fe | D. | Cu |