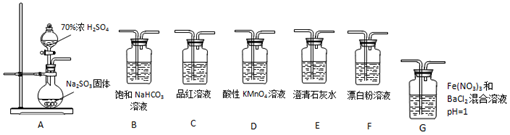
题目内容
12.对于密闭容器中进行的可逆反应:2SO2(g)+O2(g) $?_{加热}^{催化剂}$2SO3(g),下列能判断该反应已经达到化学平衡状态的是( )| A. | SO2、O2、SO3的浓度相等 | B. | SO2、O2、SO3的浓度不再发生变化 | ||
| C. | SO2、O2、SO3在密闭容器中共存 | D. | 反应停止,正、逆反应速率都等于零 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、SO2、O2、SO3的浓度相等,并不是不变,故A错误;
B、SO2、O2、SO3的浓度不再发生变化,则正逆反应速率相等,说明达平衡状态,故B正确;
C、任意时刻都是SO2、O2、SO3共存,故C错误;
D、化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
2.下列说法中正确的是( )
| A. | 1s22s12p1表示的是激发态原子的电子排布 | |
| B. | 3p2表示3p能级有两个轨道 | |
| C. | 同一原子中,3d轨道的能量小于4s轨道的能量 | |
| D. | 同一原子中,2p、3p、4p电子的能量逐渐减小 |
20.在给定条件下,下列选项中所示的物质间转化都能一步实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$→_{点燃}^{CO_{2}}$Na2CO3 | |
| B. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{盐酸}{→}$AlCl3 | |
| D. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8g O2含有4NA个电子 | |
| B. | 1L 0.1mol•L-1的氨水中有0.1NA个NH4+ | |
| C. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| D. | 1 mol苯乙烯中含碳碳双键数为4NA |
4.下列指定反应的离子方程式正确的是( )
| A. | 向[Ag(NH3)2]OH溶液中加入盐酸:Ag++Cl-═AgCl↓ | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O |
1.化学与科学技术发展进步密切相关.下列说法正确的是( )
| A. | “人造太阳”实验发生的反应:${\;}_{1}^{2}$H+${\;}_{1}^{3}$H→${\;}_{2}^{4}$He+${\;}_{0}^{1}$n,属于化学反应 | |
| B. | 长征5号推进剂液氧一煤油比长征2号推进剂N2O4-(CH3)2NNH2更环保 | |
| C. | 在某催化剂表面CO2与H2O可合成乙醇并生成O2,该反应属于放热反应 | |
| D. | 包裹聚氨酯海绵的蚕在太空成功结茧,聚氨酯海绵和蚕丝均属于天然高分子 |
2.下列有关化学用语表示正确的是( )
| A. | 中子数为10的氧原子:${\;}_{8}^{10}$O | B. | Mg2+的结构示意图: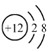 | ||
| C. | 硫化钠的电子式: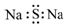 | D. | 氯乙烯的结构简式:C2H3Cl |