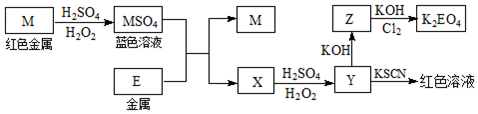
题目内容
2.在饱和硫酸铜溶液中,投入一块不规则的硫酸铜晶体,过一段时间后取出这块晶体,其形状改变,经干燥其质量不变,溶液浓度不变.分析 一定温度下溶质溶解度不变,饱和溶液加入该种溶质的晶体后会处于动态平衡,溶解进去的溶质和析出的溶质相等考虑.
解答 解:饱和溶液加入该种溶质的晶体后会处于动态平衡,溶解进去的溶质和析出的溶质相等,所以晶体的质量不变,但是形状会发生改变,溶解了多少溶质,就会析出多少溶质,原溶液仍为饱和溶液,溶液浓度不变,
故答案为:改变;不变;不变.
点评 本题考查了饱和溶液、晶体的溶解平衡,题目难度不大,解答本题关键是要知道饱和溶液中还能溶解该种溶质,只是溶解了多少溶质,就会析出多少溶质.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
2.常温下,下列说法不正确的是( )
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1mol•L-1的CH3COOH溶液中,由水电离的c(H+)为1×10-13mol•L-1 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合后溶液的pH<7 | |
| D. | 等体积pH=2的H2SO4溶液和pH=2的CH3COOH溶液混合后溶液的pH=2 |
10.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 等量的Zn分别与足量的稀硫酸和浓硫酸反应所得气体体积相同 | |
| C. | Li、Na、K的原子半价和熔沸点随原子序数的增加而增大 | |
| D. | P、C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
17.下列化合物中不属于有机物的是( )
| A. | 碳化硅(SiC) | B. | 乙酸(CH3COOH) | C. | 乙烯(C2H4) | D. | 酒精 |
7.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)某温度时,Kap=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7mol/L,则该溶液呈碱性.
(2)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列五种物质的溶液中,酸性最强的是D;将各溶液分别稀释100倍,pH变化最小的是A(填编号).
A.HCN B.HClO C.C6H5OH D.CH3COOH
③据表数据,请计算0.1mol/L的NaCN溶液中水电离出的氢氧根离子浓度1.0×10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡移动原理解释其原因因为CO32-会结合反应Cl2+H2O?H++Cl-+HClO生成的H+,使平衡向右移动(写离子方程式并用必要的文字说明)
(3)在0.1mol/L的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
14.下列离子方程式的书写及评价,均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将少量的Fe3O4溶解在过量的稀HNO3中Fe3O4+8H+=Fe2++2Fe3++4H2O | 正确,Fe2+与Fe3+物质的量之比为1:2 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应Ba2++HCO3 -+OH-═BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| A. | A | B. | B | C. | C | D. | D |
12.一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)?Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )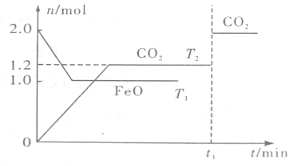

| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,T1>T2 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |