题目内容
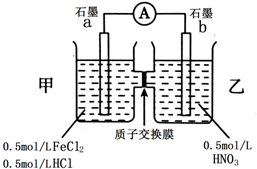
19. 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:(1)箭头所指仪器的名称是环形玻璃搅拌棒.作用是搅拌使充分反应.
(2)实验所用的NaOH溶液体积与盐酸相同,但浓度却比盐酸大的原因是保证酸完全反应.
(3)用相同浓度和体积的醋酸代替NaOH溶液进行上述实验,放出的热量会偏小.(填“偏大”“偏小”或“无影响”).测得的△H会偏大(填“偏大”“偏小”或“无影响”).
(4)如图所示实验装置存在着一处错误,这处错误是大烧杯与小烧杯未相平,散热量大.
(5)实验测得中和热△H=-57.3kJ•mol-1若忽略能量的损失,请你计算出实验前后温度的差值△t3.4℃(保留一位小数,水的比热容c=4.18J/(g•℃)两种溶液的密度近似取1g/ml )
分析 (1)箭头所指仪器的名称是环形玻璃搅拌棒,作用是在酸碱混合时起到搅拌的作用,让充分反应;
(2)让碱稍过量是为了让盐酸完全反应;
(3)醋酸是弱酸,电离过程会吸热,最终放出的热量会偏小,反应热是负值,△H会偏大;
(4)由图可知:大烧杯与小烧杯未相平,散热量大,误差较大;
(5)根据公式△H=-$\frac{Q}{n}$kJ/mol,再根据Q=m•c•△T计算.
解答 解:(1)箭头所指仪器的名称是环形玻璃搅拌棒,作用是在酸碱混合时起到搅拌的作用,让充分反应,
故答案为:环形玻璃搅拌棒;搅拌使充分反应;
(2)让碱稍过量是为了让盐酸完全反应,减小误差,
故答案为:保证酸完全反应;
(3)醋酸是弱酸,电离过程会吸热,最终放出的热量会偏小,反应热是负值,△H会偏大,
故答案为:偏小;偏大;
(4)由图可知:大烧杯与小烧杯未相平,散热量大,误差较大,
故答案为:大烧杯与小烧杯未相平,散热量大;
(5)根据公式△H=-$\frac{Q}{n}$kJ/mol═-57.3kJ•mol-1,50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液反应氢氧化钠过量,生成的水的物质的量为:50×10-3L×0.50mol•L-1=0.025mol,
所以Q=-△H×n(H2O)=57.3kJ•mol-1×0.025mol=1.4325kJ,因为Q=m•c•△t,所以△t=$\frac{Q}{m×c}$,溶液混合后的密度近似为1g/mL,所以混合后的总质量为100g,
代入数据△t=$\frac{1.4325kJ}{100g×4.18×1{0}^{-3}kJ•{g}^{-1}•{℃}^{-1}}$=3.4℃,
故答案为:3.4℃.
点评 本题考查学生有关中和热的测定知识,题目难度不大,注意掌握中和热的计算方法,明确中和热与酸、碱的物质的量无关.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案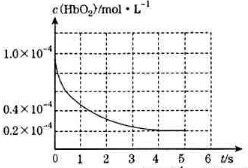 人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 反应开始至4s内用HbO2表示的平均反应速率为2×10-4mol/(L•s) | |
| B. | 反应达平衡之前,O2与HbO2的反应速率逐渐减小 | |
| C. | 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理 | |
| D. | 该温度下反应CO+HbO2?O2+HbCO的平衡常数为107 |
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
(1)D的元素名称是磷,H的元素符号是B.
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;化合物J2A2的电子式是:
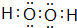 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.(3)若将标况下E的单质3.36L与通入到100mL 2mol/L的FeBr2溶液中,反应的离子方程式3Cl2+4Fe2++2Br-=6Cl-+4Fe3++Br2
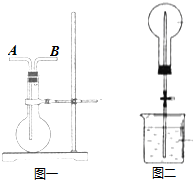
(4)G的氢化物是一种极易溶于水的气体.若用图1所示装置来收集此气体并完成喷泉实验,则气体应从图一的B口进入烧瓶(填字母).烧瓶内收集气体完成后,经测定瓶内气体的密度是相同条件下氢气密度的10.5倍,将此烧瓶按图二完成喷泉实验,请说明引发喷泉的方法用热毛巾将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气和水,NH3与水接触,即发生喷泉.实验完后液体将上升到容器容积的$\frac{2}{3}$.
(5)在Fe(GO3)2溶液中加入稀硫酸,溶液变成了黄色,有关反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(6)甲同学认为I的氧化物IO2与Na2O2反应类似于CO2与Na2O2的反应,该反应的化学方程式是2Na2O2+2SO2=2Na2SO3+O2.乙同学认为也有可能部分IO2被Na2O2氧化了,因此固体产物应该是混合物,为了检验是否有氧化产物生成,他们设计了如下方案:

上述方案是否合理?不合理.请简要说明两点理由:
①若反应后的固体中还残留有Na2O2,则溶于水后,残留的Na2O2会将SO32-氧化为SO42-;
②即使Na2O2已完全反应,加入的稀硝酸也能将BaSO3氧化为BaSO4.
(甲小组实施的为方案一,乙小组实施的为方案二)
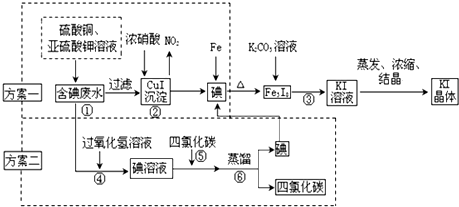
I.CuI在酸性介质中采用FeCl3氧化成即可生成单质碘.请写出上述化学反应方程式2CuI+4Fe3+═4Fe2++2Cu2++I2↓.
Ⅱ.蒸馏时用到的玻璃仪器,除接受器、锥形瓶、酒精灯外,还缺少的玻璃仪器有蒸馏烧瓶、冷凝器、温度计.
Ⅲ.甲小组为测定含碘废水中碘的含量.进行了以下实验操作:
A.各取1000g实验室废水,进行以上操作后,将所得KI晶体溶于适量水中配置成100mL溶液;
B.取KI溶液20mL于锥形瓶中;
C.用稀硫酸酸化所得KI溶液,加入足量KIO3溶液,使KIO3与KI反应完全;
D.以淀粉为指示剂,逐滴加入物质的量浓度为0.3mol•L-1的Na2S2O3溶液20.0mL,恰好反应完全.
已知:I2+2S2O32-=2I-+S4O62-;
(1)请写出步骤 C 中的离子反应方程式.5I-+IO3-+6H+=3I2↓+3H2O
(2)该废液中碘的质量分数为0.32%.
Ⅳ.(1)步骤③中的操作名称为过滤,通过该步操作还得到另一黑色固体物质.
(2)乙小组同学针对该黑色物质的成分,进行了如下步骤进行定性分析:
| 步骤 | 操作 | 现象 |
| 一 | 取黑色物质于烧杯中,加适量水进行洗涤、干燥 | 黑色物质未溶解 |
| 二 | 取适量固体于稀硫酸中进行充分溶解 | 无气体生成 |
| 三 | 移取少量步骤二溶液于试管A中,并滴加硫氰化钾溶液 | 溶液为血红色 |
| 四 | 移取少量步骤二溶液于试管B中,滴加酸性KMnO4溶液 | 酸性KMnO4溶液褪色 |
②通过以上步骤进行分析,该黑色物质可能为Fe3O4.
| A. | 利用盖斯定律可计算某些难以直接测量的反应焓变 | |
| B. | 如果一个热化学方程式可通过其他几个热化学方程式相加减而得到,则该反应的焓变可由相对应的热化学方程式的焓变相加减而得到 | |
| C. | 当同一个化学反应以不同的途径完成时,反应的焓变也是不同的 | |
| D. | 对于放热反应,放出的热量越多,焓变越小 |
| A. | 橡胶 | B. | 玻璃块 | C. | 水晶 | D. | 淀粉 |
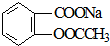 转变为
转变为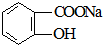 的方法为( )
的方法为( )| A. | 与足量NaOH溶液共热后,再通入CO2 | |
| B. | 与足量NaOH溶液共热后,再加入稀硫酸 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量Na2CO3 |
| A. | 戊醇 | B. | 戊烷 | ||
| C. | 戊烯 | D. | 戊醛(C5H10O,仅含一个-CHO) |