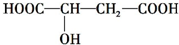题目内容
9.已知向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池.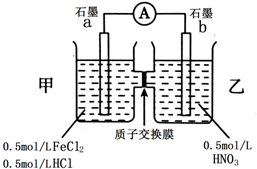
(1)写出FeCl2与稀硝酸反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(2)图中电子流动方向为a极到b极.
(3)在乙烧杯中会观察到的现象为生成无色气体,遇到空气变红棕色,写出乙烧杯中的电极反应方程式4H++NO3-+3e-=NO↑+2H2O.
(4)H+流向乙烧杯,若一段时间内流向该烧杯的H+有0.05mol,则消耗Fe2+2.8g
(5)该装置存在的缺点可能是(写一点)正极生成的NO会污染空气.
(6)若将乙烧杯的稀硝酸换成浓硝酸,写出a电极上的电极反应方程式Fe2+-e-=Fe3+.
分析 (1)亚铁离子与稀硝酸反应生成NO、铁离子和水;
(2)原电池中电子从负极流向正极;
(3)乙烧杯中硝酸根离子得电子生成NO,NO遇到空气生成二氧化氮;
(4)原电池中,溶液中阳离子向正极移动,根据电荷守恒计算;
(5)正极产物为有毒气体;
(6)乙烧杯的稀硝酸换成浓硝酸,负极上仍然是亚铁离子失电子生成铁离子.
解答 解:(1)亚铁离子与稀硝酸反应生成NO、铁离子和水,则FeCl2与稀硝酸反应的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(2)亚铁离子在负极上失电子,则a为负极,b为正极,原电池中电子从负极流向正极,即电子从a极流向b极;
故答案为:a;b;
(3)b为正极,正极上硝酸根离子得电子生成NO,则正极反应式为:4H++NO3-+3e-=NO↑+2H2O;乙烧杯中硝酸根离子得电子生成NO,NO遇到空气生成二氧化氮,所以生成的无色气体会变为红棕色;
故答案为:生成无色气体,遇到空气变红棕色;4H++NO3-+3e-=NO↑+2H2O;
(4)原电池中,溶液中阳离子向正极移动,则H+流向乙烧杯,若一段时间内流向该烧杯的H+有0.05mol,则外电路中转移电子为0.05mol,负极电极反应为:Fe2+-e-=Fe3+,则消耗Fe2+为0.05mol,其质量为0.05mol×56g/mol=2.8g;
故答案为:乙;2.8;
(5)正极反应式为:4H++NO3-+3e-=NO↑+2H2O,正极产物NO为有毒气体,会污染空气;
故答案为:正极生成的NO会污染空气;
(6)乙烧杯的稀硝酸换成浓硝酸,负极上仍然是亚铁离子失电子生成铁离子,则a极上反应式为:Fe2+-e-=Fe3+;
故答案为:Fe2+-e-=Fe3+.
点评 本题考查了离子反应、原电池原理的应用、元素化合物的性质,题目难度中等,注意把握原电池中正负极的判断以及电极方程式的书写,侧重于考查学生对基础知识的综合应用能力.

| A. | 反应不需要加热即可进行反应 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 理论上可以使该反应的化学能直接转化为电能 |
(1)分子数(2)体积(3)密度(4)原子数.
| A. | 仅(1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | 以上都不相同 |
| A. | 硫酸钠的电离方程式:Na2SO4=Na2++SO42- | |
| B. | Mg2+的结构示意图: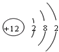 | |
| C. | 氮气的结构式::N≡N: | |
| D. | 氯化镁的电子式: |
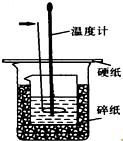 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: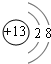 .
. ;
;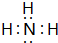 ,G的结构式为
,G的结构式为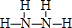 .
.