题目内容
1.下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Na+、Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| B | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2═CO32-+H2O |
| C | H+,Fe2+、SO42-、Cl- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl-、NO3- | 少量澄淸石灰水 | Al3++3OH-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe3+、I-发生氧化还原反应;
B.通人少量CO2,先与NH3•H20反应;
C.酸性条件下,NO3-具有强氧化性;
D.Al3+与0H-反应生成沉淀.
解答 解:A.Fe3+、I-之间发生氧化还原反应,在溶液中不能共存,故A错误;
B.通人少量CO2,NH3•H2O优先反应,正确的离子方程式为:2NH3•H2O+CO2═CO32-+H2O+2NH4+,故B错误;
C.加入硝酸钡后,硝酸根离子在酸性条件下氧化亚铁离子,正确的离子方程式为:NO3-+3Fe2++4H+═NO↑+3Fe3++2H2O、SO42-+Ba2+═BaSO4↓,故C错误;
D.Al3+与少量氢氧化钙反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3OH-═Al(OH)3↓,故D正确;
故选D
点评 本题考查了离子方程式的书写、离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
11.下列实验对应的现象与结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将浓硫酸入蔗糖中 | 固体变黑后发生膨胀 | 浓硫酸具有吸水性和强还原性 |
| B | 将两小粒相同的钠分别投入乙醇和水中 | 钠在水中反应比在乙醇中剧烈 | 相同条件下,水的电离能力比乙醇强 |
| C | 向某溶液滴加氯水后再滴入KCSN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 常温时将铝片加入浓硝酸中 | 未出现气泡 | 常温下铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
12.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )


| A. | K1、K2闭合时,Na+均移向铁棒 | |
| B. | K1闭合,石墨棒周围溶液pH逐渐升高 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
9.下列说法错误的是( )
| A. | 非金属元素的两原子之间不可能形成离子键 | |
| B. | 离子化合物不可能全部由非金属元素组成 | |
| C. | 含有非极性键的分子不一定是共价化合物 | |
| D. | 离子化合物中一定含有离子键. |
16.某芳香醇分子式为C8H10O,它的结构有( )
| A. | 5种 | B. | 9种 | C. | 14种 | D. | 16种. |
6.物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当它们的体积比为1:2:3时,三种溶液中Cl-的物质的量之比为( )
| A. | 3:4:3 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:4:9 |
13.7瓶分别含有Cu2+、Fe3+、A13+、Mg2+、Fe2+、NH4+、Na+等离子的溶液,只用一种试剂即可鉴别,该试剂是( )
| A. | KMnO4溶液 | B. | KSCN溶液 | C. | NaOH溶液 | D. | NH3•H2O溶液 |
13.有人曾建议用 AG 表示溶液的酸度,AG 的定义为:AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下实验室用0.01mol?L-1 的氢氧化钠溶液滴定 20mL 相同浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )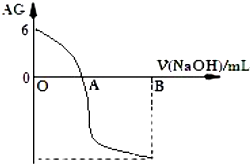

| A. | A 点时加入氢氧化钠溶液体积为 20 mL | |
| B. | OA 段溶液中:c(CH3COO-)>c(CH3COOH) | |
| C. | 室温时 0.01 mol/L的醋酸溶液 pH=4 | |
| D. | 若 B 点时加入 NaOH 溶液为 40 mL,所得溶液中:c(CH3COO-)+c(CH3COOH)=c(OH-) |
14.将足量的MnO2与含14.6gHCl的浓盐酸共热制取氯气,可制得Cl2的质量是( )
| A. | 等于7.1g | B. | 小于7.1g | ||
| C. | 大于7.1g,小于14.2g | D. | 大于14.2g |