题目内容
14.将足量的MnO2与含14.6gHCl的浓盐酸共热制取氯气,可制得Cl2的质量是( )| A. | 等于7.1g | B. | 小于7.1g | ||
| C. | 大于7.1g,小于14.2g | D. | 大于14.2g |
分析 发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,随反应进行浓盐酸变稀,稀盐酸不二氧化锰反应,故14.6HCl不能完全反应.
解答 解:假设HCl完全反应,生成氯气质量为m,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
146 71
14.6g m
所以m=$\frac{14.6g×71}{146}$=7.1g
随反应进行浓盐酸变稀,稀盐酸不二氧化锰反应,故14.6HCl不能完全反应,则可制得Cl2的质量小于7.1g.
故选:B.
点评 本题考查学生利用化学反应方程式的计算,关键是明确稀盐酸不二氧化锰反应,注意对元素化合物性质的掌握,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
1.下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Na+、Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| B | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2═CO32-+H2O |
| C | H+,Fe2+、SO42-、Cl- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl-、NO3- | 少量澄淸石灰水 | Al3++3OH-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
5.用阳极a和阴极b电解c的水溶液一段时间,然后加入d,能使溶液恢复到电解前状态,a、b、c、d正确组合是( )
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
2.下列的各组离子在酸性溶液中能大量共存的是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ca2+、SO32-、ClO- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
9.二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒.实验室通过如下过程制备二氧化氯.
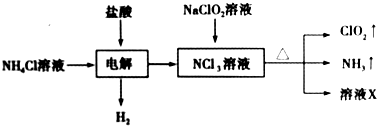
下列说法正确的是( )

下列说法正确的是( )
| A. | 电解时发生反应的离子方程式为NH4++3Cl-$\frac{\underline{\;电解\;}}{\;}$2H2↑+NCl3 | |
| B. | 溶液X中大量存在的阴离子有Cl-、OH- | |
| C. | 可用饱和食盐水除去ClO2中的NH3 | |
| D. | 可用明矾除去饮用水中残留的NaClO2 |
19.二氧化碳的捕集、利用与封存是能源领域的一个重要研究课题
(1)在太阳能作用下,以CO2为原料制取碳(C)的流程如图1所示.
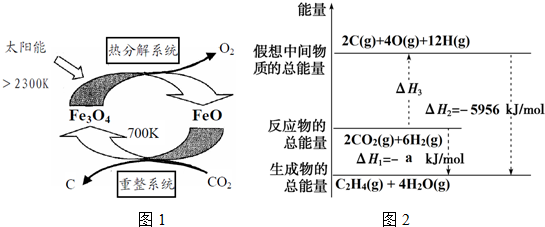
①热分解系统每分解0.5mol Fe3O4转移电子的物质的量为1mol.
②该系统的总反应的化学方程式是CO2═C+O2.
(2)二氧化碳催化加氢可合成低碳烯:
2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H1=-a kJ•mol-1,有关能量变化如图2所示:
①几种物质具有的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时放出或吸收的热量即为其具有的能量)如表所示:
则a=128
②几种化学键的键能如下:
则b=436
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图三所示.
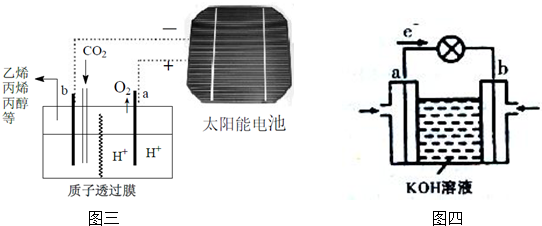
①该工艺中能量转化方式主要有太阳能转化为电能、电能转化为化学能(写出其中两种形式即可).
②其中b极上生成丙烯(CH3CH=CH2)的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
③乙烯和氧气反应通过上图四装置可将化学能转化为电能,b电极反应式为O2+2H2O+4e-=4OH-.
(1)在太阳能作用下,以CO2为原料制取碳(C)的流程如图1所示.

①热分解系统每分解0.5mol Fe3O4转移电子的物质的量为1mol.
②该系统的总反应的化学方程式是CO2═C+O2.
(2)二氧化碳催化加氢可合成低碳烯:
2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H1=-a kJ•mol-1,有关能量变化如图2所示:
①几种物质具有的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时放出或吸收的热量即为其具有的能量)如表所示:
| 物质 | CO2(g) | C2H4(g) | H2O(g) |
| 能量/kJ•mol-1 | -394 | 52 | -242 |
②几种化学键的键能如下:
| 化学键 | C=O | H-H | C=C | O-H |
| 键能/kJ•mol-1 | 803 | b | 615 | 463 |
(3)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图三所示.

①该工艺中能量转化方式主要有太阳能转化为电能、电能转化为化学能(写出其中两种形式即可).
②其中b极上生成丙烯(CH3CH=CH2)的电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O.
③乙烯和氧气反应通过上图四装置可将化学能转化为电能,b电极反应式为O2+2H2O+4e-=4OH-.
3.实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g样品,溶于水配成250.00mL溶液,取出该溶液25.00mL用0.1mol•L-1盐酸进行滴定,得到如下曲线.以下说法正确的是( )
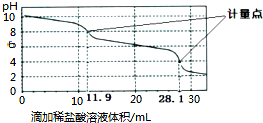

| A. | 上一计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| B. | 下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- | |
| C. | 此样品n(NaHCO3)=(28.1-2×11.9)×10-3mol | |
| D. | 使用该方法测定Na2CO3和NaOH混合物中氢氧化钠含量,将会得到1个计量点 |
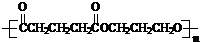 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下: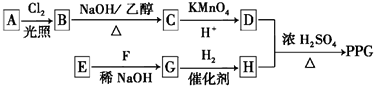
 .
.
 .
. .
. .
.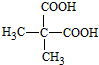 .
.