题目内容
9.下列说法错误的是( )| A. | 非金属元素的两原子之间不可能形成离子键 | |
| B. | 离子化合物不可能全部由非金属元素组成 | |
| C. | 含有非极性键的分子不一定是共价化合物 | |
| D. | 离子化合物中一定含有离子键. |
分析 A.非金属元素的原子之间可能形成离子键;
B.铵盐是全部由非金属元素组成的离子化合物;
C.含有非极性键的分子可能是单质;
D.含有离子键的化合物属于离子化合物.
解答 解:A.非金属元素的原子之间可能形成离子键,如氯化铵中铵根离子与氯离子存在离子键,故A错误;
B.铵盐是全部由非金属元素组成的离子化合物,所以离子化合物可能全部由非金属元素组成,故B错误;
C.含有非极性键的分子可能是单质,如氯气是含有非极性键的分子,属于单质,故C正确;
D.含有离子键的化合物属于离子化合物,则离子化合物中一定含有离子键,可能含有共价键,故D正确.
故选AB.
点评 本题考查化学键,明确化学键的形成及判断的一般规律即可解答,并学会利用实例来分析解答,题目难度不大.

练习册系列答案
相关题目
19.25℃时,向1mLpH=a的盐酸中滴加1OmLpH=b的NaOH溶液,当溶液中n(Cl-)=n(Na+)时,则a+b的值为
( )
( )
| A. | 13 | B. | 14 | C. | 15 | D. | 不能确定 |
20.次氯酸可用于杀菌消毒,已知25℃时:
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(1)△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ•mol-1
下列说法正确的是( )
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(1)△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | 在25℃时,次氯酸的电离方程式及热效应可表示为:HClO(aq)=H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| B. | 将20mL 1mol/L HClO与10mL1mol/L NaOH混合后的溶液,一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) | |
| C. | 将0.2mol/L NaClO 与0.1mol/L HCl等体积混合后的溶液,溶液显碱性,则存在:c(ClO-)>c(Cl-)>c(HClO)>c(OH-) | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
17.下列化学用语正确的是( )
| A. | H2S的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | S2-的结构示意图: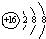 | |
| C. | Na2O2的电子式:Na+[$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$]2-Na+ | |
| D. | CCl4的电子式: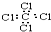 |
14.离子晶体之间的决定于离子键的大小,下列按离子键由大到小排列的是( )
| A. | NaF>NaCl>NaBr>NaI | B. | Na20>Na2S>NaCl>NaI | ||
| C. | NaCl>CaCl2>MgCl2>AlCl3 | D. | MgCO3>CaCO3>SrCO3>BaCO3 |
1.下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Na+、Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| B | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2═CO32-+H2O |
| C | H+,Fe2+、SO42-、Cl- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl-、NO3- | 少量澄淸石灰水 | Al3++3OH-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
1. 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )| A. | 选用酚酞作指示剂的滴定终点的判断:当浅红色变为无色且半分钟内仍为无色时即为滴定终点 | |
| B. | 滴定终点读数时,俯视滴定管的刻度(其他操作均正确),会造成测定结果偏低 | |
| C. | 甲滴定管中盛有H2SO4溶液,液面恰好在10.00mL刻度处,并把甲滴定管中的H2SO4溶液全部放入烧杯中,其体积为40.00mL | |
| D. | 量取15.00mLKMnO4溶液应选择乙滴定管 |
2.下列的各组离子在酸性溶液中能大量共存的是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ca2+、SO32-、ClO- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
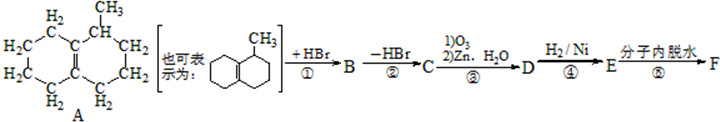 该小组经过上述反应.最终得到F1(
该小组经过上述反应.最终得到F1( )外,还得到它的同分异构体,其中BCDEF分别代表一种或多种物质.
)外,还得到它的同分异构体,其中BCDEF分别代表一种或多种物质.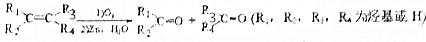
 .
. ;
; .
.