题目内容
常温下,甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、甲酸能与水以任意比互溶 |
| B、1mol/L甲酸溶液的pH值约为2 |
| C、10ml 1mol/L甲酸恰好与10ml?1mol/L NaOH溶液完全反应 |
| D、HCOONa溶液的pH值大于7 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:如果能说明甲酸在水溶液里部分电离就能证明甲酸是弱电解质,据此分析解答.
解答:
解:A.甲酸能与水以任意比互溶,说明甲酸溶解性大,但不能说明甲酸部分电离,所以不能证明甲酸是弱电解质,故A错误;
B.1mol/L甲酸溶液的pH值约为2,则溶液中c(H+)=0.01mol/L<1mol/L,说明甲酸部分电离,所以能证明甲酸是弱电解质,故B正确;
C.10ml 1mol/L甲酸恰好与10ml?1mol/L NaOH溶液完全反应,说明甲酸是一元酸,不能说明甲酸部分电离,所以不能证明甲酸是弱电解质,故C错误;
D.HCOONa溶液pH>7,说明甲酸钠是强碱弱酸盐,所以证明甲酸是弱酸,故D正确;
故选BD.
B.1mol/L甲酸溶液的pH值约为2,则溶液中c(H+)=0.01mol/L<1mol/L,说明甲酸部分电离,所以能证明甲酸是弱电解质,故B正确;
C.10ml 1mol/L甲酸恰好与10ml?1mol/L NaOH溶液完全反应,说明甲酸是一元酸,不能说明甲酸部分电离,所以不能证明甲酸是弱电解质,故C错误;
D.HCOONa溶液pH>7,说明甲酸钠是强碱弱酸盐,所以证明甲酸是弱酸,故D正确;
故选BD.
点评:本题考查弱电解质的判断,知道强弱电解质的本质区别是“电离程度”,电解质强弱只根据电离程度判断,不能根据其溶解性强弱判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验不能达到目的是( )
A、 测定一定时间内生成H2的反应速率 |
B、 用CO2作喷泉实验 |
C、 验证NH3易溶于水实验 |
D、 测定酸碱中和反应的中和热 |
下列说法不正确的是( )
| A、利用丁达尔现象可以鉴别胶体和溶液 |
| B、在豆浆里加入盐卤做豆腐与胶体的聚沉有关 |
| C、胶体与溶液的分离可用渗析的方法 |
| D、KCl溶液、淀粉溶液和纯水都属于分散系 |
铁是人体的重要营养元素,铁在人体内的主要功能是以血红蛋白(含低价铁)的形式参加氧的转运、交换、和组织呼吸过程,以及在体内用于生产供给生命活动需要的细胞能量ATP.人体正常的血红蛋白应该含Fe2+.若误食亚硝酸盐,则导致血红蛋白中Fe2+转化成Fe3+而中毒,服用维生素C可解毒.下列叙述正确的是( )
| A、亚硝酸盐是还原剂 |
| B、维生素C是氧化剂 |
| C、维生素C将Fe3+还原为Fe2+ |
| D、亚硝酸盐被氧化 |
在海洋底部存在大量称为“可燃冰”的物质,其蕴藏量是地球上煤、石油的几百倍,因而是一种等待开发的巨大能源物质.初步查明可燃冰是甲烷、乙烷等可燃性气体的水合物.有关可燃冰的下述推测中不正确的是( )
| A、高压、低温有助于可燃冰的形成 |
| B、构成可燃冰的原子间存在极性共价键 |
| C、可燃冰的微粒间可能存在一种比范德华力更强的相互作用力 |
| D、常温、常压下可燃冰是一种稳定的物质 |
可以说明HCOOH是弱酸的事实是( )
| A、甲酸与水能以任意比混溶 |
| B、甲酸能与Na2CO3溶液反应,生成CO2气体 |
| C、1mol/L的HCOOH水溶液能使紫色石蕊试液变红 |
| D、1mol/L的HCOONa溶液的pH约为8.5 |
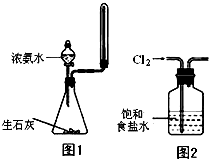 下列有关实验没有明显错误的是( )
下列有关实验没有明显错误的是( )| A、使用湿润过的pH试纸测量某溶液的pH |
| B、实验室可以用图1所示装置来制取少量氨气 |
| C、用量筒量取20 mL 0.50mol?L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.10mol?L-1H2SO4溶液 |
| D、实验室用图2所示装置除去Cl2中的少量HCl |
下列说法正确的是( )
| A、绿色化学就是研究绿色物质的化学 |
| B、烷烃是一类饱和链烃,其分子都是直线型的 |
| C、甲烷是烷烃中碳元素的质量分数最低的,也是最简单的烃 |
| D、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂 |
 可逆反应:2A(g)+B(g)?2C(g)在温度分别为T1、T2,压强分别为p1、p2条件下测得C的体积分数与时间t的关系如图所示,下列判断正确的是:
可逆反应:2A(g)+B(g)?2C(g)在温度分别为T1、T2,压强分别为p1、p2条件下测得C的体积分数与时间t的关系如图所示,下列判断正确的是:( )
| A、p2<p1,逆反应放热 |
| B、p2>p1,正反应放热 |
| C、p2>p1,正反应吸热 |
| D、p2<p1,逆反应吸热 |