题目内容
2.有下列物质:①CO2、②KCl、③硅单质、④O2、⑤NH4Cl、⑥Ca(OH)2、⑦H2SO4、⑧金刚石、⑨H2O2、⑩Na2O2、⑪氩单质.试用以上编号填空:(1)只有非极性键的是③④⑧.
(2)只有离子键的是②.
(3)既有离子键,又有非极性键的是⑩.
(4)属于共价化合物的是①⑦⑨.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:①CO2中只含极性键,属于共价化合物;
②KCl只含有离子键的离子化合物;
③硅单质只含非极性键的单质;
④O2中只含非极性键,属于单质;
⑤NH4Cl中含有离子键和极性键,属于离子键化合物;
⑥Ca(OH)2中含有离子键和极性键,属于离子键化合物;
⑦H2SO4中只含极性键,属于共价化合物;
⑧金刚石只含非极性键的单质;
⑨H2O2含有H-O极性键和O-O非极性键,属于共价化合物;
⑩Na2O2中含有离子键和非极性键,属于离子键化合物;
⑪氩单质不含任何化学键的单质.
(1)只有非极性键的是③④⑧;
(2)只有离子键的是②;
(3)既有离子键,又有非极性键的是⑩;
(4)属于共价化合物的是①⑦⑨;故答案为:(1)③④⑧(2)②(3)⑩(4)①⑦⑨.
点评 本题考查了物质和化学键的关系,明确物质中存在的化学键是解本题关键,题目难度不大.

练习册系列答案
相关题目
17.反应CH3OH(g)+NH3(g)═CH3NH2(g)+H2O(g)在高温下才能自发向右进行,则该反应的△H、△S应为( )
| A. | △H>0、△S<0 | B. | △H<0、△S>0 | C. | △H>0、△S>0 | D. | △H<0、△S<0 |
7.①~⑨是元素周期表中的部分元素.
请回答:
(1)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是OH-+Al(OH)3=AlO2-+2H2O.
(2)用电子式表示元素⑥和⑨形成的化合物的过程 .
.
(3)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:
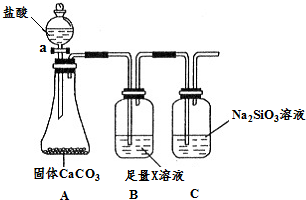
a.X是NaHCO3(填化学式),B装置的作用是吸收二氧化碳中混有的HCl气体.
b.能说明元素②和硅元素非金属性强弱的实验现象是C中产生白色胶状沉淀,相关的化学方程式是:CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓.
(4)请设计实验比较元素⑥与⑦金属性的相对强弱取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | |||||||
(1)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是OH-+Al(OH)3=AlO2-+2H2O.
(2)用电子式表示元素⑥和⑨形成的化合物的过程
 .
.(3)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:

a.X是NaHCO3(填化学式),B装置的作用是吸收二氧化碳中混有的HCl气体.
b.能说明元素②和硅元素非金属性强弱的实验现象是C中产生白色胶状沉淀,相关的化学方程式是:CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓.
(4)请设计实验比较元素⑥与⑦金属性的相对强弱取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
14.下列关于资源及其利用的说法正确的是( )
| A. | 煤的干馏,石油的裂化和裂解均属于化学变化 | |
| B. | 利用铝热反应可以冶炼Fe、Cr、Mn、W、Na等金属 | |
| C. | 甲烷和氯气制备一氯甲烷的原子利用率可达100% | |
| D. | SO2、NO2、CO2均是导致酸雨的主要原因 |
12.下列叙述正确的是( )
| A. | 蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有性脱水性 | |
| B. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| C. | 将SO2通入BaCl2溶液能生成白色沉淀 | |
| D. | 可用澄清石灰水溶液鉴别 CO2和SO2 |
 .
.



 3,4-二甲基辛烷.
3,4-二甲基辛烷. 2,3,4-三甲基己烷.
2,3,4-三甲基己烷.