题目内容
7.化学与环境密切相关.下列措施不利于“蓝天工程”建设的是( )| A. | 开发利用太阳能、风能等,减少对化石能源的依赖 | |
| B. | 监测大气中的PM2.5,改善空气质量 | |
| C. | 大力实施矿物燃料和脱硫脱硝技术以减少SO2、NOx的排放 | |
| D. | 加高工厂烟囱,使烟尘和废气远离地表 |
分析 减少化石能源的使用、减少污染物的排放可改善空气质量,而加高工厂烟囱,不能减少工业废气的排放,以此来解答.
解答 解:A.开发利用太阳能、风能等,减少对化石能源的依赖,使用清洁能源利于“蓝天工程”建设,故A不选;
B.监测大气中的PM2.5,减少固体颗粒物的排放,可改善空气质量,利于“蓝天工程”建设,故B不选;
C.大力实施矿物燃料和脱硫脱硝技术以减少SO2、NOx的排放,可减少酸雨、光化学烟雾的发生,利于“蓝天工程”建设,故C不选;
D.加高工厂烟囱,使烟尘和废气远离地表,不能从根本上减少污染物的排放,仍污染空气,不利于“蓝天工程”建设,故D选;
故选D.
点评 本题考查环境问题,为高频考点,把握常见的环境污染物、环境问题、蓝天工程为解答的关键,侧重分析与应用能力的考查,注意化学与环境的联系,题目难度不大.

练习册系列答案
相关题目
8.5个碳的烷烃的同分异构体共有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
6.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1.8gNH${\;}_{4}^{+}$和2.3gNa+所含的电子数均为NA | |
| B. | 0.4molCu与0.8molHNO3(稀)反应,转移电子数为0.8NA | |
| C. | 3.2gCu与足量的HNO3(浓)反应生成的气体分子数为0.1NA | |
| D. | 1molCl2与足量的铁反应,转移的电子数为3NA |
2.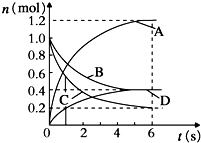 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 0~1s内,v(A)=v(c) | |
| C. | 0~6s内,B的平均反应速率为0.05mol/(L•s) | |
| D. | 0~6s内,各物质的反应速率相等 |
12.设NO+NO2?NO2+CO(正反应吸热)反应速率为v1;N2+3H2?NH3(正反应放热)反应速率为v2.对于前述反应,当温度升高时,v1和v2变化情况为( )
| A. | v1增大,v2减小 | B. | v1减小,v2增大 | C. | 同时增大 | D. | 同时减小 |
19.下列物质属于复合材料的是( )
| A. | 再生塑料 | B. | 人造皮革 | C. | 钢化玻璃 | D. | 玻璃钢 |
16.A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素,I是地壳中含量位于第二位的金属元素.已知
①A元素的原子半径在周期表中最小
②B元素原子的最外层电子数是次外层电子数的两倍
③C元素最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可形成E2D、E2D2两种离子化合物
⑤H、D两元素同主族,G、H两元素同周期
⑥G元素是同周期中离子半径最小的元素.回答下列问题:
(1)写出B、H两种元素形成化合物的结构式S=C=S,A、D、E三种元素形成的化合物的电子式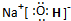 ,写出③中生成盐的化学键类型离子键和共价键.
,写出③中生成盐的化学键类型离子键和共价键.
(2)甲、乙、丙分别是B、G、H三种元素最高价含氧酸的钠盐(包括酸式盐),甲、乙都能与丙发生反应,且丙用量不同,反应产物不同.则向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是开始无明显现象,后来生成大量无色气体,向乙溶液中缓慢滴加过量的丙溶液发生的离子反应方程式为H++AlO2-+H2O=Al(OH)3↓和Al(OH)3+3H+=Al3++3H2O.
(3)由元素F和I形成的氢氧化物难溶于水,常温下它们的溶度积如下:
向含有F2+、I3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(F2+):c(I3+)=2.125×1021.
①A元素的原子半径在周期表中最小
②B元素原子的最外层电子数是次外层电子数的两倍
③C元素最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可形成E2D、E2D2两种离子化合物
⑤H、D两元素同主族,G、H两元素同周期
⑥G元素是同周期中离子半径最小的元素.回答下列问题:
(1)写出B、H两种元素形成化合物的结构式S=C=S,A、D、E三种元素形成的化合物的电子式
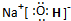 ,写出③中生成盐的化学键类型离子键和共价键.
,写出③中生成盐的化学键类型离子键和共价键.(2)甲、乙、丙分别是B、G、H三种元素最高价含氧酸的钠盐(包括酸式盐),甲、乙都能与丙发生反应,且丙用量不同,反应产物不同.则向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是开始无明显现象,后来生成大量无色气体,向乙溶液中缓慢滴加过量的丙溶液发生的离子反应方程式为H++AlO2-+H2O=Al(OH)3↓和Al(OH)3+3H+=Al3++3H2O.
(3)由元素F和I形成的氢氧化物难溶于水,常温下它们的溶度积如下:
| 物质 | F(OH)2 | I(OH)3 |
| Ksp | 5.61×10-12 | 2.64×10-39 |
17.下列关于CO的叙述正确的是( )
| A. | CO的摩尔质量是28g | |
| B. | 1mol CO中所含分子数为6.02×1023个 | |
| C. | 1 mol CO的质量是28 g/mol | |
| D. | 常温常压下,1 mol CO的体积为22.4 L |
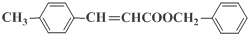 )的流程:
)的流程: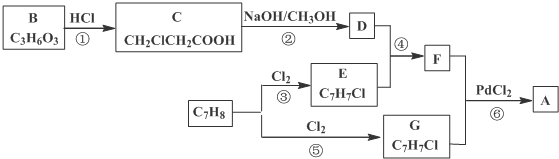
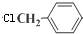
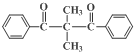 、、
、、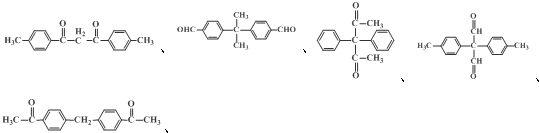 (其中两种).
(其中两种).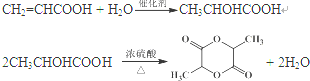 .
.